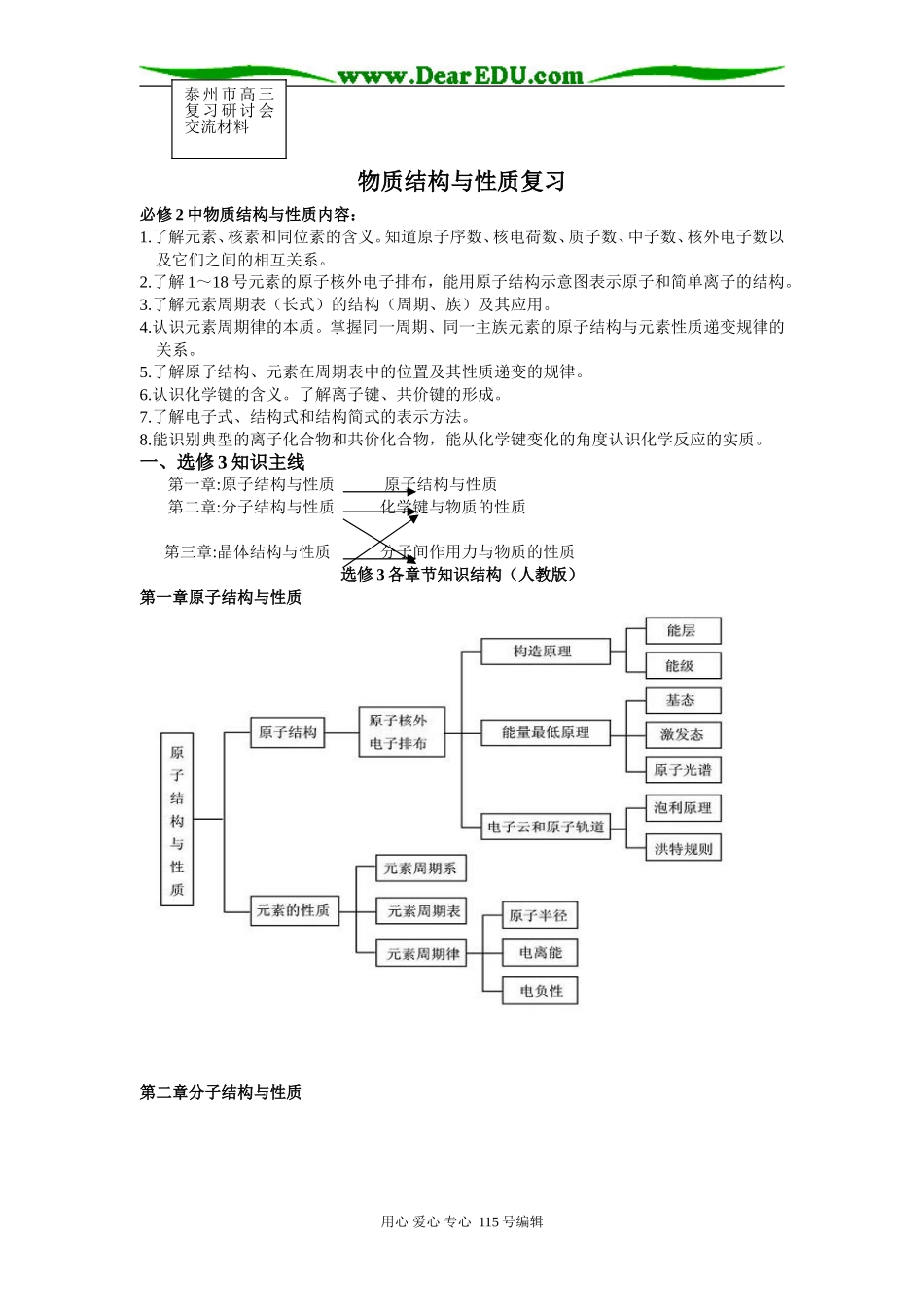
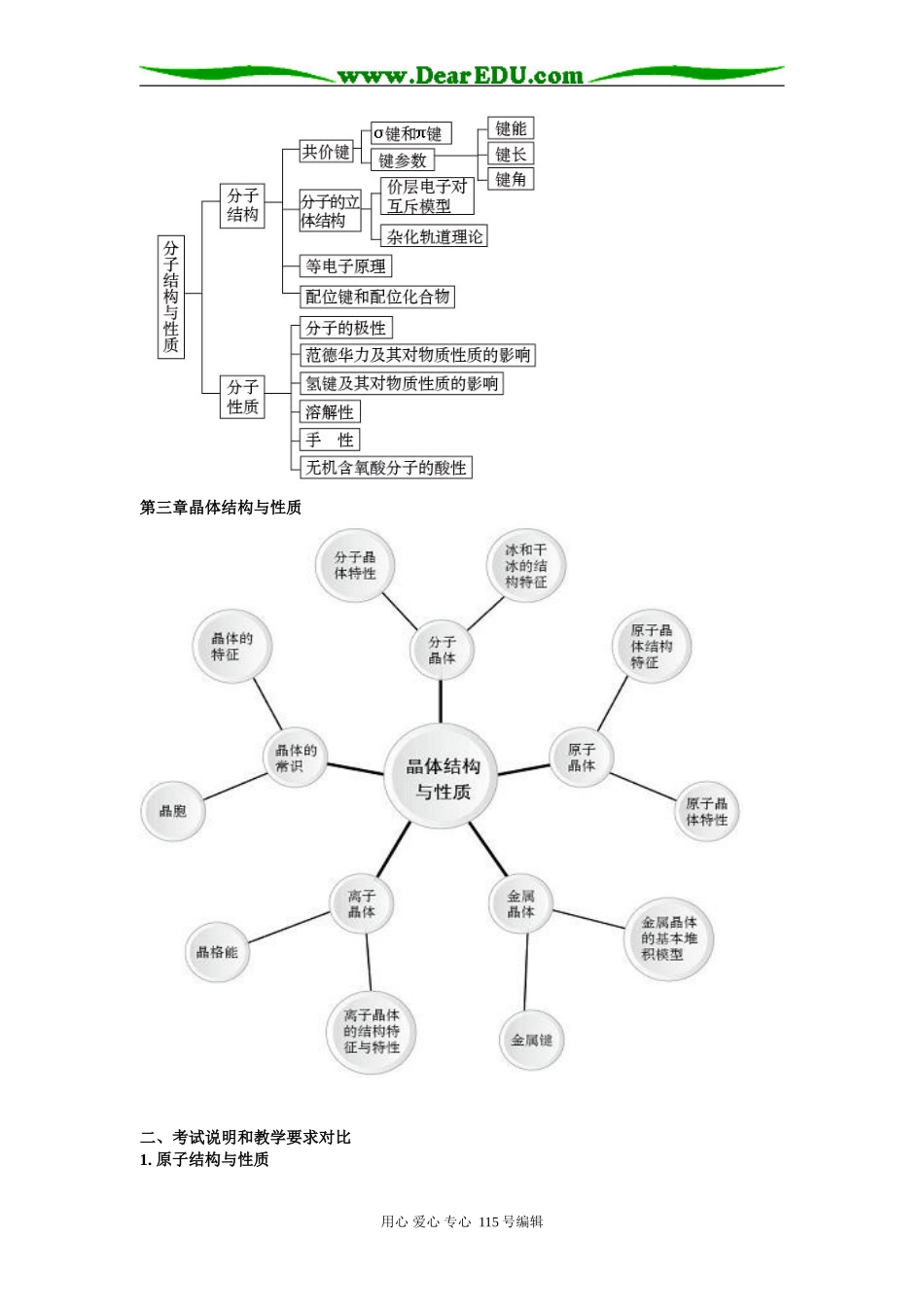
物质结构与性质复习必修2中物质结构与性质内容:1.了解元素、核素和同位素的含义。知道原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。2.了解1~18号元素的原子核外电子排布,能用原子结构示意图表示原子和简单离子的结构。3.了解元素周期表(长式)的结构(周期、族)及其应用。4.认识元素周期律的本质。掌握同一周期、同一主族元素的原子结构与元素性质递变规律的关系。5.了解原子结构、元素在周期表中的位置及其性质递变的规律。6.认识化学键的含义。了解离子键、共价键的形成。7.了解电子式、结构式和结构简式的表示方法。8.能识别典型的离子化合物和共价化合物,能从化学键变化的角度认识化学反应的实质。一、选修3知识主线第一章:原子结构与性质原子结构与性质第二章:分子结构与性质化学键与物质的性质第三章:晶体结构与性质分子间作用力与物质的性质选修3各章节知识结构(人教版)第一章原子结构与性质第二章分子结构与性质用心爱心专心115号编辑泰州市高三复习研讨会交流材料第三章晶体结构与性质二、考试说明和教学要求对比1.原子结构与性质用心爱心专心115号编辑考试说明教学要求(1)认识原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义。1.了解原子核外电子的运动特征。2.知道电子云的涵义。3.知道在多电子原子中,核外电子是分层排布的。4.知道电子层(能层)、原子轨道(能级)、电子自旋的涵义。主量子数、角量子数、磁量子数和自旋磁量子数等概念不作要求。(2)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。5.知道不同原子轨道的形状、伸展方向、能量高低顺序和表示形式。6.知道不同电子层(能层)含有的原子轨道的类型、数目和不同能级(原子轨道)最多可容纳的电子数。7.知道多电子原子中核外电子分层排布遵循的原理(能量最低原理、泡利不相容原理和洪特规则)。8.了解电子排布式的涵义,能用电子排布式表示常见元素(1~36号)原子核外电子的排布。9.知道元素的原子外围电子排布式的涵义,能说出根据元素原子外围电子排布的特征对元素周期表分区的情况。(3)了解同一周期、同一主族中元素电离能的变化规律,了解元素电离能和原子核外电子排布的关系。10.知道元素电离能的涵义。11.认识同一周期、同一主族中元素电离能的变化规律,了解元素电离能和原子核外电子排布的关系。12.能应用元素电离能说明原子或离子失去电子的难易、元素主要化合价等的周期性变化。(4)了解同一周期、同一主族中元素电负性的变化规律,能根据元素电负性说明周期表中元素金属性和非金属性的变化规律。13.知道元素电负性的涵义。14.了解元素电负性和元素在化合物中吸引电子能力的关系,认识同一周期、同一主族中元素电负性的变化规律。15.能根据元素电负性大小说出主族元素的金属性和非金属性的强弱。无(但能量最低原理的描述中对应第16条,杂化的了解和必修中焰色反应的认识对应第17条)16.知道原子核外电子在一定条件下会发生跃迁。17.了解其在生活、生产和科学研究中的简单应用。2.化学键与物质的性质考试说明教学要求(1)理解离子键的含义,能说明离子键的形成。1.理解离子键的涵义,能说明离子键的形成。2.能根据离子化合物的结构特征解释其物理性质。(2)了解NaCl型和CsCl型离子晶体的结构特征。能用晶格能解释离子化合物的物理性质。3.知道晶胞的涵义。4.了解晶格能的涵义。5.了解影响离子晶体的晶格能大小的因素。6.知道晶格能的大小可以衡量离子晶体中离子键的强弱。7.知道离子晶体晶格能的大小和离子晶体熔点高低、硬度大小的关系。(3)了解共价键的主要类型σ键和π键,8.知道共价键的形成原因、本质、特征。用心爱心专心115号编辑能用键能、键长、键角等数据说明简单分子的某些性质(对σ键和π键之间相对强弱的比较不作要求)。10.知道共价键的主要类型σ键和π键形成的原理及强度大小。11.知道共价键的键能、键长、键角等的涵义。12.能用键能、键长、键角等说明简单分子的某些性质。(4)了解极性键和非极性键,了解极性分子和非极性分子...