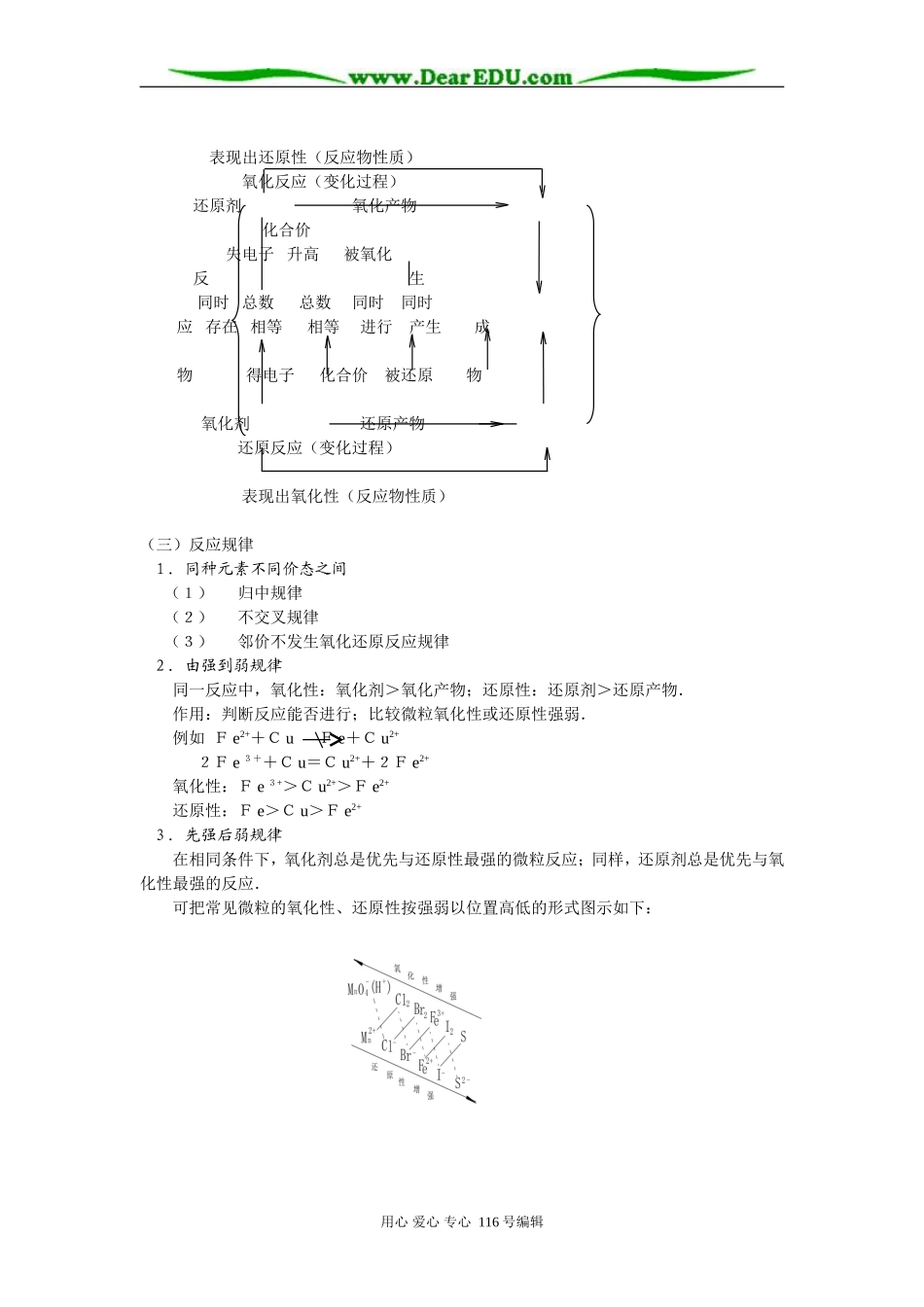
高三复习专题讲座-化学反应中的物质变化和能量变化一、本周教学进度及主要内容:第三册第三章化学反应中的物质变化和能量变化本讲主要内容:1.了解常见的重要氧化剂、还原剂2.比较氧化性、还原性的强弱3.氧化还原反应的重要规律4.理解离子反应的本质和反应条件5.判断离子反应方程式的正误和离子共存问题6.理解化学变化中的能量变化,正确书写热化学方程式7.理解反应热和键能之间的关系,了解燃烧热和中和热的概念二、学习指导(一)常见的重要氧化剂、还原剂氧化剂还原剂活泼非金属单质:X2(X=F、Cl、Br)、O2、S活泼金属单质:Na、Mg、Al、Zn、Fe某些非金属单质:C、H2、S高价金属离子:Fe3+、Sn4+不活泼金属离子:Cu2+、Ag+其它:H+、[Ag(NH3)2]+、新制Cu(OH)2低价金属离子:Fe2+、Sn2+非金属的阴离子及其化合物:S2-、H2S、I-、HI、NH3、Cl-、HCl、Br-、HBr含氧化合物:NO2、N2O5、MnO2、Na2O2、H2O2、HClO、HNO3、浓H2SO4、NaClO、Ca(ClO)2、KClO3、KMnO4、王水低价含氧化合物:CO、SO2、H2SO3、Na2SO3、Na2S2O3、NaNO2、H2C2O4、含-CHO的有机物:醛、甲酸、甲酸盐、甲酸某酯、葡萄糖、麦芽糖等既可作氧化剂又可作还原剂的有:S、SO32-、HSO3-、H2SO3、SO2、NO2-、Fe2+等,及含-CHO的有机物(二)氧化—还原反应的一般概念用心爱心专心116号编辑表现出还原性(反应物性质)氧化反应(变化过程)还原剂氧化产物化合价失电子升高被氧化反生同时总数总数同时同时应存在相等相等进行产生成物得电子化合价被还原物氧化剂还原产物还原反应(变化过程)表现出氧化性(反应物性质)(三)反应规律1.同种元素不同价态之间(1)归中规律(2)不交叉规律(3)邻价不发生氧化还原反应规律2.由强到弱规律同一反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物.作用:判断反应能否进行;比较微粒氧化性或还原性强弱.例如Fe2++CuFe+Cu2+2Fe3++Cu=Cu2++2Fe2+氧化性:Fe3+>Cu2+>Fe2+还原性:Fe>Cu>Fe2+3.先强后弱规律在相同条件下,氧化剂总是优先与还原性最强的微粒反应;同样,还原剂总是优先与氧化性最强的反应.可把常见微粒的氧化性、还原性按强弱以位置高低的形式图示如下:用心爱心专心116号编辑应用:1.虚线所指两种微粒一定能发生反应,故不共存;实线所指微粒能共存.2.左上方的一种氧化剂可氧化它右下方的还原性微粒.若有多种,则优先氧化较下方的微粒.2.选择合适的氧化剂或还原剂,如要氧化Fe2+而Br-不被氧化,则可选择Br2.(四)比较氧化性、还原性强弱的依据.注意:得失电子能力大小≠得失电子数目多少1.根据金属活动顺序表还原性减弱KCaNaMgAlZnFeSnPb(H)CuHgAgK+Ca2+Na+Mg2+Al3+Zn2+Fe2+Sn2+Pb2+(H+)Cu2+Hg2+Ag+氧化性增强2.根据氧化-还原反应氧化性:氧化剂>氧化产物还原性:还原剂>还原产物3.根据原电池、电解池中的电极反应正极或阴极:强氧化剂+ne=弱还原性产物负极或阳极:强还原剂-ne=弱氧化性产物4.根据周期表位置同周期主族元素从左到右金属阳离子或非金属单质越右越上氧化性越强金同属主单越族质左元或越素非下从金还上属原到阴性下离越子强5.同种元素不同价态①最低价态元素只表现出还原性(如S2-、I-)最高价态元素只表现出氧化性(如Fe3+、H+)中间价态元素及其物质在一定条件下既可表现氧化性、又可表现还原性.(如用心爱心专心116号编辑SO2、S)②一般而言,同种元素从低价到高价氧化性渐增,还原性渐弱.如:Mn2+MnO2MnO42-MnO4-Fe3+Fe2+Fe但是:HClOHClO2HClO3HClO4事实上:物质的氧化性或还原性强弱与元素价态高低无绝对的内在关系.6.根据反应条件,剧烈程度等①2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O事实1.常温、稀盐酸即可发生.②MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O事实2,不加热、或盐酸稀到一定程度则反应停止,根据以上事实,可得出氧化性:KMnO4>MnO2(五)反应条件对氧化-还原反应的影响.1.浓度:可能导致反应能否进行或产物不同Cu+H2SO4(稀)不反应Cu+2H2SO4(浓)CuSO4+SO2↑+H2OCu+4HNO3(浓)=Cu(...