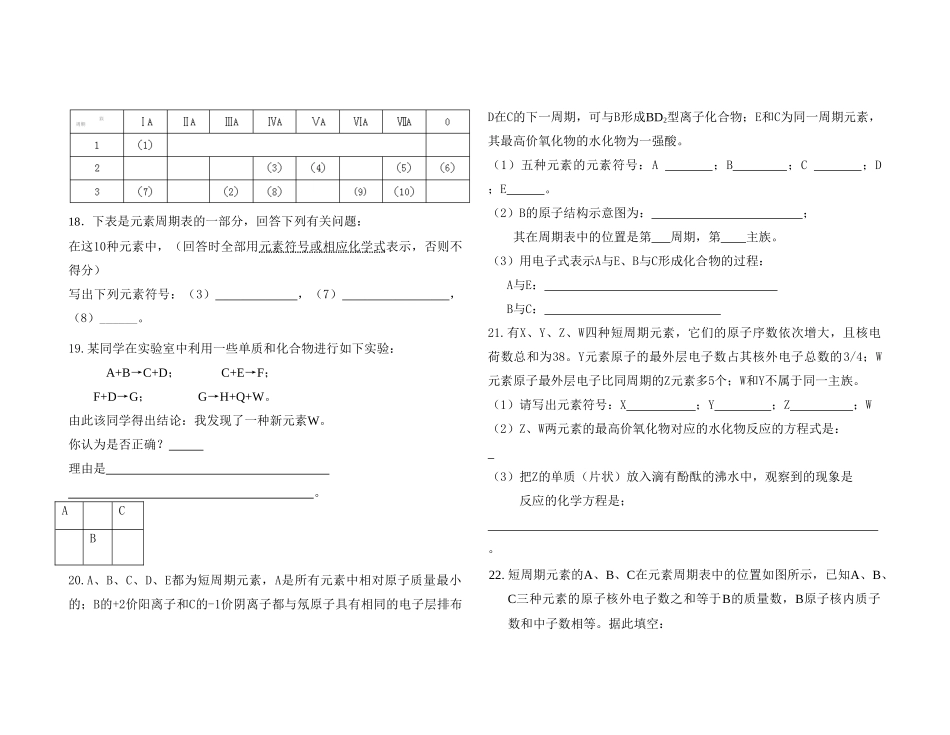
高一下学期化学练习一(第一章物质结构一、选择题(每小题只有一个正确答案)1.下列元素中,最高正化合价数值最大的是()A.CB.SC.FD.Ne2.下列化合物中,阳离子半径与阴离子半径比值最小的是()A.NaFB.NaClC.MgI2D.KBr3.下列说法正确的是()A.难失电子的原子,得电子的能力一定强B.易得电子的原子,失电子的能力一定弱C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大D.任何原子的原子核都是由质子和中子构成的4.已知a、b分别为同周期的ⅠA和ⅦA族的两种元素,它们的原子序数分别为m和n,则下列关系不可能成立的是()A.n=m+16B.n=m+6C.n=m+30D.n=m+105.a、b、c、d、e是同周期的五种元素,a和b的最高价氧化物的水化物显碱性,且碱性b>a,c和d的气态氢化物的还原性d>c。五种元素的原子,得失电子后所形成的简单离子中,e的离子半径最小,则它们的原子序数由小到大的顺序是()A.b、a、e、d、cB.e、d、a、b、cC.a、b、d、c、eD.c、d、e、a、b6.元素X的原子有3个电子层,最外层有4个电子。这种元素位于周期表的()A.第4周期ⅢA族B.第4周期ⅦA族C.第3周期ⅣB族D.第3周期ⅣA族7.某元素原子的最外电子层上只有2个电子,该元素是()A.一定是IIA元素B.一定是金属元素C.一定是正二价元素D.可能是金属元素,也可能是非金属元素8.国际无机化学命名委员会在1989年做出决定,把长式元素周期表原先的主副族及族号取消,由左至右改为18列。如碱金属为第1列,稀有气体元素为第18列。按此规定下列说法中错误的是()A.第9列元素中没有非金属元素B.第17列为卤族元素C.只有第2列元素原子的最外层有2个电子D.在整个18列元素中,第3列元素种类最多9.下列关于原子的几种描述中,不正确的是()A.18O与19F具有相同的中子数B.16O与17O具有相同的电子数C.12C与13C具有相同的质量数D.14N与15N具有相同的质子数10.下列氢氧化物中碱性最强的是()A.KOHB.NaOHC.LiOHD.CsOH11.天然存在的Fr极微量,它的21种同位素都有放射性,它是碱金属中最重的元素,根据它在周期表中的位置预言其性质,其中不正确的是()A.在已知碱金属中它具有最多的电子层B.在空气中燃烧的时候,生成氧化物Fr2OC.氧化物对应的水化物是极强的碱D.单质的熔点不如Na的高12.某元素的最外层只有一个电子,当它跟卤素原子结合时可形成的化学键()A.一定是共价键B.一定是离子键C.可能是共价键也可能是离子键D.上述说法都不对13.下列事实不能用来判断金属性强弱的是()A.金属间发生置换反应B.1mol金属单质在反应中失去的电子数C.金属元素的最高价氧化物的水化物的碱性强弱D.金属单质与水或酸反应置换出氢的难易14.下列变化中离子键受到破坏的是()A.NaOH溶于水B.HCl溶于水C.SiO2熔化D.I2升华15.下列叙述正确的是()A.单质分子中一定存在着共价键B.气态物质中一定存在着共价键C.全部由非金属构成的化合物一定不存在离子键D.在共价化合物中一定含有共价键16.某元素R的气态氢化物为H2R,则它的最高价氧化物对应的水化物的化学式为()A.HRO3B.HRO4C.H2RO4D.H3RO4二、非选择题17.A、B、C、D四种元素均为短周期元素,其原子半径依次减小,它们的气态氢化物分子所含的电子数相同,C元素原子的K层电子数与M层电子数之和等于L层电子数。根据以上信息,按要求写出以下化学式(用A、B、C、D所代表的真实元素符号表示)。(1)A的最高价氧化物;(2)B的气态氢化物;(3)C的最高价氧化物的水化物;(4)D的单质。18.下表是元素周期表的一部分,回答下列有关问题:在这10种元素中,(回答时全部用元素符号或相应化学式表示,否则不得分)写出下列元素符号:(3),(7),(8)______。19.某同学在实验室中利用一些单质和化合物进行如下实验:A+B→C+D;C+E→F;F+D→G;G→H+Q+W。由此该同学得出结论:我发现了一种新元素W。你认为是否正确?理由是。ACB20.A、B、C、D、E都为短周期元素,A是所有元素中相对原子质量最小的;B的+2价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布D在C的下一周期,可与B形成BD2型离子化合物;E和C为同一周期元素,其最高价氧化物的水化物为一强酸。(1)五种元素的元素符号:A;B;C;D...