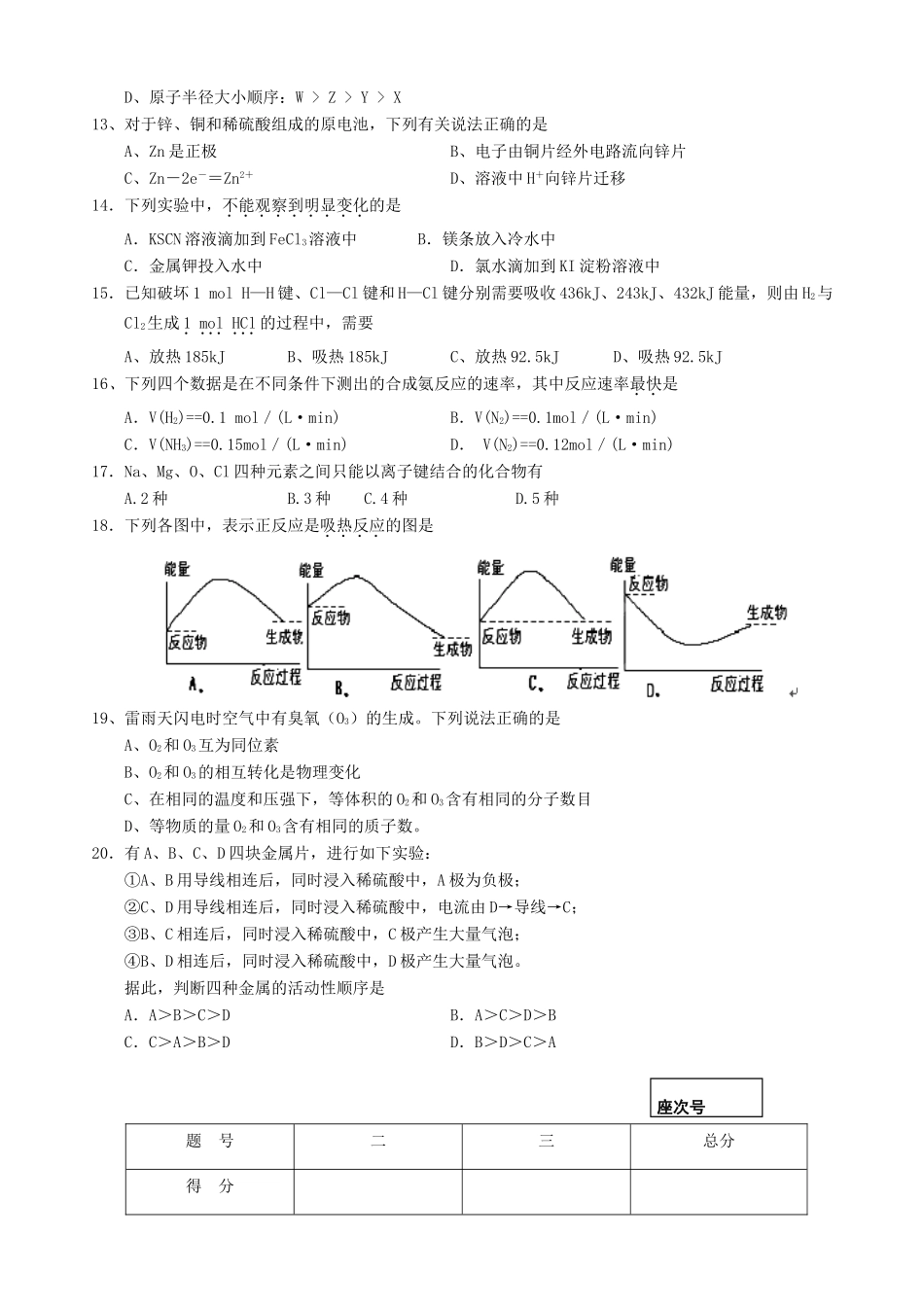
张掖二中2013—2014学年度第二学期期中考试试卷高一化学(时间:100分钟总分:100分)一、选择题(每题3分,共60分)1.下列反应既属于氧化还原反应,又是吸热反应的是A.Ba(OH)2·8H2O与NH4Cl的反应B.灼热的碳与CO2的反应C.铝片与稀盐酸的反应D.甲烷在氧气中的燃烧反应2.某元素最高价氧化物对应水化物的化学式是H3XO4,这种元素的气态氢化物化学式是A.H2XB.HXC.XH3D.XH43.下列物质既含有离子键又含有共价键的是A.NaClB.CO2C.NaOHD.O34.下列各原子序数所表示的两种元素,能形成AB2型离子化合物的是A.6和8B.11和13C.11和16D.12和175.下列各组中的性质比较,不正确的是A.稳定性:NH3<PH3<SiH4B.酸性:HClO4>H2SO4>H3PO4C.碱性:KOH>NaOH>Mg(OH)2D.还原性:F-<Cl-<Br-6.已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是A.B.C.D.7.下列变化中,不需要破坏化学键的是A.NO与O2反应B.碘加热升华C.氯酸钾加热分解D.氯化钠溶于水8.砷为第四周期ⅤA族元素,依据它在周期表中的位置,推测砷不可能具有的性质是A.砷在通常状况下为固体B.砷的最高正化合价为+5价C.砷的最高价氧化物的水化物砷酸(H3AsO4)的酸性比磷酸(H3PO4)强D.砷化氢(AsH3)不如氨气(NH3)稳定9.下列说法正确的是A.含有离子键的化合物一定是离子化合物B.气态单质分子中一定存在共价键C.含有共价键的化合物一定是共价化合物D.含有离子键的化合物不一定是离子化合物10.对于可逆反应M+NQ达到平衡时,下列说法中,正确的是A.M、N、Q三种物质的浓度一定相等B.M、N全部变成了QC.反应混合物各成分的浓度不再变化D.反应已经停止11、为了描述方便,人们常常用电子式来表示原子、分子,下列电子式正确的ABCD12.X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法正确的是A、W单质与水反应,生成一种具有漂白性的物质B、最高价氧化物对应水化物的酸性强弱顺序:Z>W>XC、四种元素的氢化物中,Z的氢化物最稳定XYZWD、原子半径大小顺序:W>Z>Y>X13、对于锌、铜和稀硫酸组成的原电池,下列有关说法正确的是A、Zn是正极B、电子由铜片经外电路流向锌片C、Zn-2e-=Zn2+D、溶液中H+向锌片迁移14.下列实验中,不能观察到明显变化的是A.KSCN溶液滴加到FeCl3溶液中B.镁条放入冷水中C.金属钾投入水中D.氯水滴加到KI淀粉溶液中15.已知破坏1molH—H键、Cl—Cl键和H—Cl键分别需要吸收436kJ、243kJ、432kJ能量,则由H2与Cl2生成1molHCl的过程中,需要A、放热185kJB、吸热185kJC、放热92.5kJD、吸热92.5kJ16、下列四个数据是在不同条件下测出的合成氨反应的速率,其中反应速率最快是A.V(H2)==0.1mol/(L·min)B.V(N2)==0.1mol/(L·min)C.V(NH3)==0.15mol/(L·min)D.V(N2)==0.12mol/(L·min)17.Na、Mg、O、Cl四种元素之间只能以离子键结合的化合物有A.2种B.3种C.4种D.5种18.下列各图中,表示正反应是吸热反应的图是19、雷雨天闪电时空气中有臭氧(O3)的生成。下列说法正确的是A、O2和O3互为同位素B、O2和O3的相互转化是物理变化C、在相同的温度和压强下,等体积的O2和O3含有相同的分子数目D、等物质的量O2和O3含有相同的质子数。20.有A、B、C、D四块金属片,进行如下实验:①A、B用导线相连后,同时浸入稀硫酸中,A极为负极;②C、D用导线相连后,同时浸入稀硫酸中,电流由D→导线→C;③B、C相连后,同时浸入稀硫酸中,C极产生大量气泡;④B、D相连后,同时浸入稀硫酸中,D极产生大量气泡。据此,判断四种金属的活动性顺序是A.A>B>C>DB.A>C>D>BC.C>A>B>DD.B>D>C>A题号二三总分得分座次号二、填空题(每空2分,共30分)21.(12分)在一个小烧杯里加入约20g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10g氯化铵晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:(1)写出有关的化学方程式:(2)观察到“结冰”现象,说明反应是一个________(填“放出”或“吸收”)能量的反应,即断开旧化学键__________(填“放出”或“吸收”)能量____________(填“>”或...