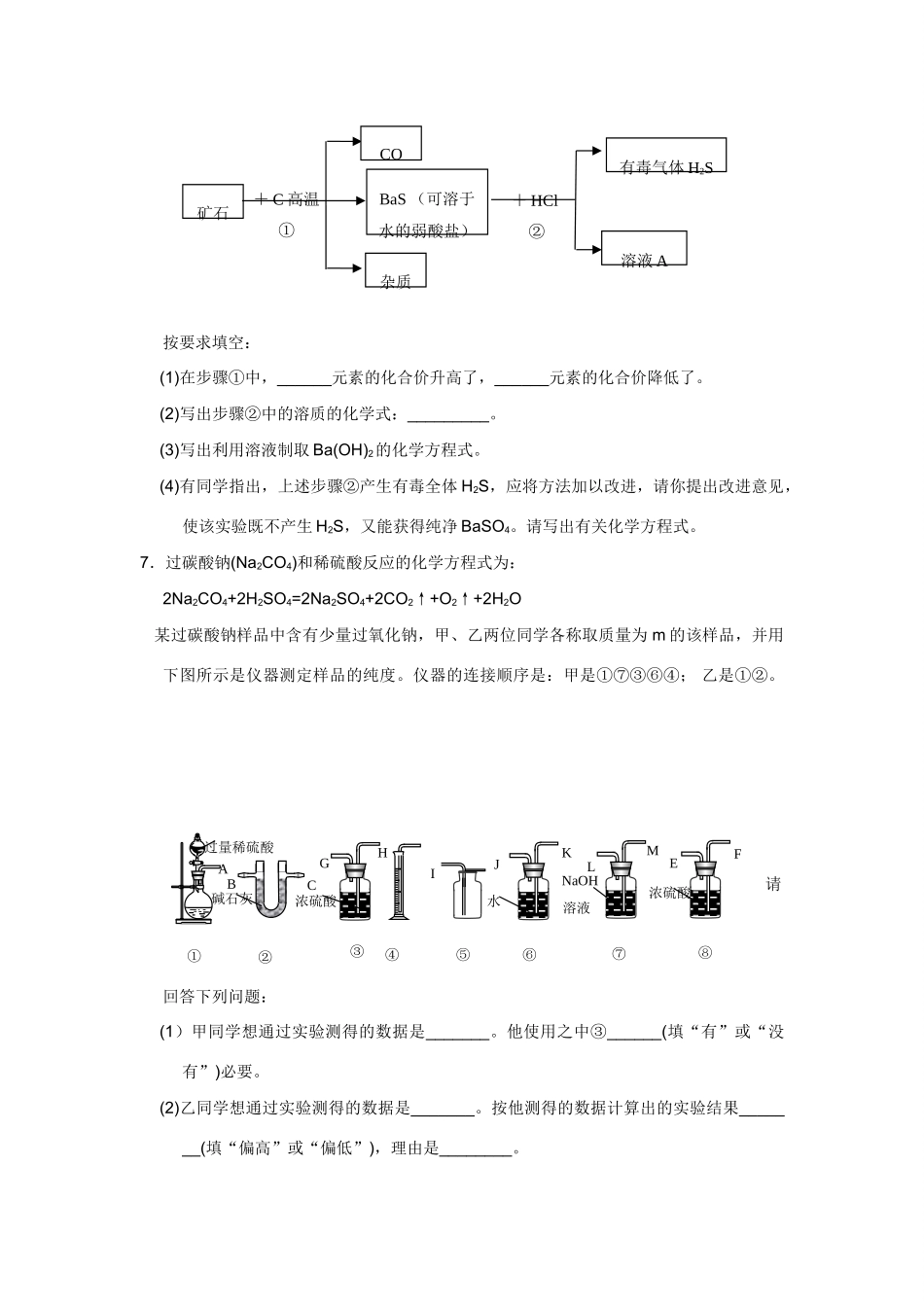
31、化学实验方案的设计与评价1.现有一种含氯化钾、硫酸钾、碳酸钾和少量不溶酸的粗钾盐杂质,试设计三种不同的方法来测定粗钾盐中碳酸钾的含量,简述实验过程。2.实验室临时需要用NaOH溶液和CO2来制取Na2CO3溶液,但CO2气体在通入NaOH溶液时极易因其过量而生成NaHCO3,且无明显现象。请设计一个简单的实验,以NaOH稀溶液和由大理石、稀盐酸制得CO2制取纯的Na2CO3溶液,简述其实验步骤。3.某学生为将含有少量杂质铜的氯化铁提纯,拟定以下实验步骤:①把样品加蒸馏水溶解;②过滤除去杂质;③把滤液加热蒸干,以得到FeCl3晶体。(1)你以为此方案是否科学?试用化学方程式和简要文字表述其理由。(2)请你设计提纯氯化铁的方案(只要求写出提纯步骤,最多只允许6步完成)。4.硫酸亚铁是一种可用于治疗缺铁性贫血的药剂。硫酸亚铁药片外表包有一层特制的糖衣,以保护硫酸亚铁不被空气中氧气氧化成硫酸铁(硫酸铁治疗贫血无效)。试设计一个实验方案,验证某硫酸亚铁药片是否被氧化。写出主要实验步骤,并简明说出每一步的目的、现象和有关离子方程式。5.有三位同学分别设计了如下实验方案,并都认为如果观察到的实验现象和自己设计的方案一致,即可确认混合气体中含有CO2和SO2气体。方案甲:无色气体酸性高锰酸钾溶液(褪色)澄清石灰水(浑浊)方案乙:无色气体棕黄色溴水(褪色)澄清石灰水(浑浊)方案丙:无色气体品红溶液(颜色变浅)澄清石灰水(浑浊)试评价上述各方案是否严密,并说明理由。甲:_____________;乙:_______________;丙:______________。6.自然界矿物中有一种重晶石矿的主要成分是BaSO4,它不溶于任何酸、碱和水,纯净的BaSO4可供医疗等方面应用。某课外活动小组用重晶石矿和焦炭为原料制取纯净的BaSO4(设矿物中杂质不与焦炭反应,也不溶于水)的部分流程图如图所示:通入通入通入通入通入通入按要求填空:(1)在步骤①中,______元素的化合价升高了,______元素的化合价降低了。(2)写出步骤②中的溶质的化学式:_________。(3)写出利用溶液制取Ba(OH)2的化学方程式。(4)有同学指出,上述步骤②产生有毒全体H2S,应将方法加以改进,请你提出改进意见,使该实验既不产生H2S,又能获得纯净BaSO4。请写出有关化学方程式。7.过碳酸钠(Na2CO4)和稀硫酸反应的化学方程式为:2Na2CO4+2H2SO4=2Na2SO4+2CO2↑+O2↑+2H2O某过碳酸钠样品中含有少量过氧化钠,甲、乙两位同学各称取质量为m的该样品,并用下图所示是仪器测定样品的纯度。仪器的连接顺序是:甲是①⑦③⑥④;乙是①②。请回答下列问题:(1)甲同学想通过实验测得的数据是_______。他使用之中③______(填“有”或“没有”)必要。(2)乙同学想通过实验测得的数据是_______。按他测得的数据计算出的实验结果_______(填“偏高”或“偏低”),理由是________。矿石COBaS(可溶于水的弱酸盐)杂质有毒气体H2S溶液A+C高温①+HCl②ACBGHIJKLMFE①②③④⑤⑥⑧⑦过量稀硫酸碱石灰浓硫酸水浓硫酸NaOH溶液(3)为了测得准确的实验数据,请你将乙同学的实验装置进行改进(每种仪器只准使用一次),写出各仪器接口的连接顺序。(4)按你设计的实验之中进行实验,若测得实验前后装置②的质量分别是w1和w2,则样品中过碳酸钠的质量分数为__________。8.实验室用浓盐酸、MnO2、共热制Cl2,并用Cl2和Ca(OH)2反应制少量漂粉精。现已知反应2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O;△H<0。温度稍高即发生反应6Cl2+Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三个同学分别设计的三套实验装置如图所示。(1)有下列几项优、缺点:a.不容易控制反应速率;b.容易控制反应速率;c.有副反应发生;d.可防止副反应发生;e.污染环境;f.可防止污染环境。请对图中所示的甲、乙、丙三套装置的优缺点作出评析,选择符合题目要求的选项填在下列空格内。甲乙丙消石灰消石灰澄清石灰水氢氧化钠溶液ABCDEFG(2)所示装置中,甲由A、B两部分组成;乙由C、D、E三部分组成;丙由F、G两部分组成。请从图A~G各部分装置中选取合理的组成部分,组装成一套较完善的实验装置,装置的连接顺序(按气流从左到右的方向)是_________。(3)实验中若用100mL12mol·L...