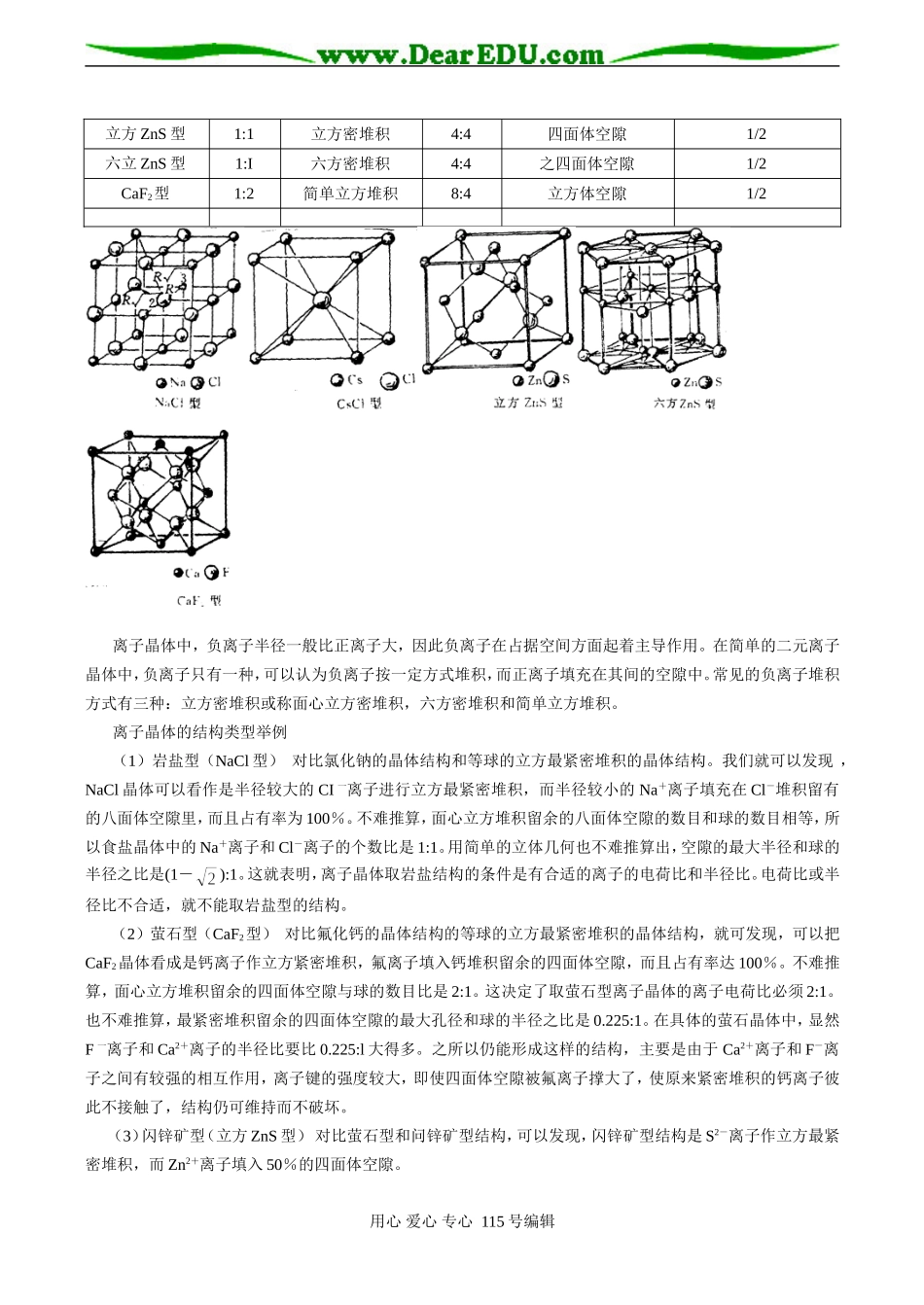
高一化学第二节空间正多面体一.认识与掌握正四面体、正方体、正八面体、正十二面体、正二十面体、碳—60的模型及在化学中的应用二.掌握与理解空间多面体点、线、面间的关系三.初步掌握晶体密度的求算方法例1.空间正方体与正四面体的关系①试计算甲烷分子的键角(用反三角函数表示)②CH4分子在空间呈四面体形状,1个C原子与4个H原子各共用一对电子对形成4条共价键,右图为一个正方体,已画出1个C原子(在正方体中心)、1个H原子(在正方体顶点)和1条共价键(实线表示),请画出另3个H原子的合适位置和3条共价键,任意两条共价键的余弦值为________③98-1-4例2.空间正方体与正八面体的关系①连接正方体六个面的面心构成的空间几何构型是什么?②连接正八面体八个面的面心构成的空间几何构型是什么?③比较正方体与正八面体的空间关系?④例题SF6是一种无色气体,具有很强的稳定性,可用于灭火。SF6的分子结构(见右图)呈正八面体型。如果F元素有两种稳定的同位素,则SF6的不同分子种数为例3.空间四面体与正八面体的关系和组合①连接正四面体六条棱的中点构成的空间几何构型是什么?②连接正八面体不相邻八个面的面心构成的空间几何构型是什么?③金刚烷空间结构分析④例题计算金刚烷二氯取代物和一氯一溴取代物的同分异构体数目。例4.空间正十二面体与正二十面体的关系①连接正十二面体十二个面的面心构成的空间几何构型是什么?②连接正二十面体二十个面的面心构成的空间几何构型是什么?③比较正十二面体与正二十面体的空间关系?④例题晶体硼的基本结构单元是由硼原子组成的正二十面体(如右图所示),右边每个三角形均为正三角形,每个顶点为一硼原子。则每一个此基本单元由个原子组成;该单元中有2个原子为10B(其余为11B),那么该结构单元有种不同类型。例5.碳—60与富勒烯空间结构特点分析①C60结构与正十二面体和正二十面体的空间关系②利用点线面关系和不饱和度原理分析富勒烯的空间结构③富勒烯各结构的关系和共性例题98-3-4第三节分子空间结构分析利用杂化轨道理论、价层电子互斥理论和等电子体原理分析分子的空间结构。用心爱心专心115号编辑FFFSFFF例题①判断下列分子或离子的空间构型PCl4+AlF63-XeF6NO3-N3-NO2+IO65-②99-2-2第四节配合物的空间结构当化学组成相同的一些配合物,由于配位体在中心离子(原子)周围的排列情况或配位方式不同,而引起的结构和性质不同的现象称为配合物的异构现象。由于很多配合物的化学式比较复杂,因而会出现许多不同类型的异构现象。但其中最重要的是由于中心离子和配位体的相对几何位置不同所引起的异构现象,称为配合物的几何异构现象。它主要发生在平面正方形和八面体结构的配合物中。在这类配合物中,配位体在中心离子周围可以占据不同形式的位置,通常有顺式和反式两种异构体。顺式是指相同配位体彼此处于邻位,反式是指相同配位体彼此处于对位。如平面正方形构型的[PtCl2(NH)2]存在二种几何异构体:而[Pt(NH3)(NH2OH)(py)(NO2)]+离子有三种几何异构体:几何异构现象对于配位数为2的直线型、为3的平面三角形和为和为4的正四面体型的配合物是不存在的,因为它们的配位位置都彼此是相邻的。配离子的空间构型如右表所示:配合物中也存在旋光异构现象(详见第六节)例题试分别图示下列平面正方形配合物和八面体配合物的几何构体,并指出八面体配合物各右几对对映体。①[Ma2cd]②[Mabcd]③[Ma2c2]④[Ma4ef]⑤[Ma3def]⑥[Ma2cdef]⑦[Ma4e2]第五节离子晶体的空间结构对于简单的二元离子晶体来说,正负离子在空间的排列方式(即结构型式)主要取决于正负离子的数量比(或称组成比)和半径比。常见的五种二元离子晶体典型结构型式汇列在下表中:结构型式组成比负离子堆积方式CN+/CN-正离子占据空隙种类正离子所占空隙分数NaCl型1:1立方密堆积6:6八面体空隙1CsCl型1:l简单上方堆积8:8立方体空隙1用心爱心专心115号编辑配位数空间构型典型实例2直线型[Ag(NH3)2]+[Au(CN)2]-3平面三角形[CuCl3]2-4四面体[Cd(NH3)3]2+[ZnCl4]2-平面正方形[PtCl4]2-[Ni(CN)4]2-5三角双锥[CuCl5]3-四方锥[TiF5]2-6八面体[Co(NH3)6]3+[Cr(NH3)...