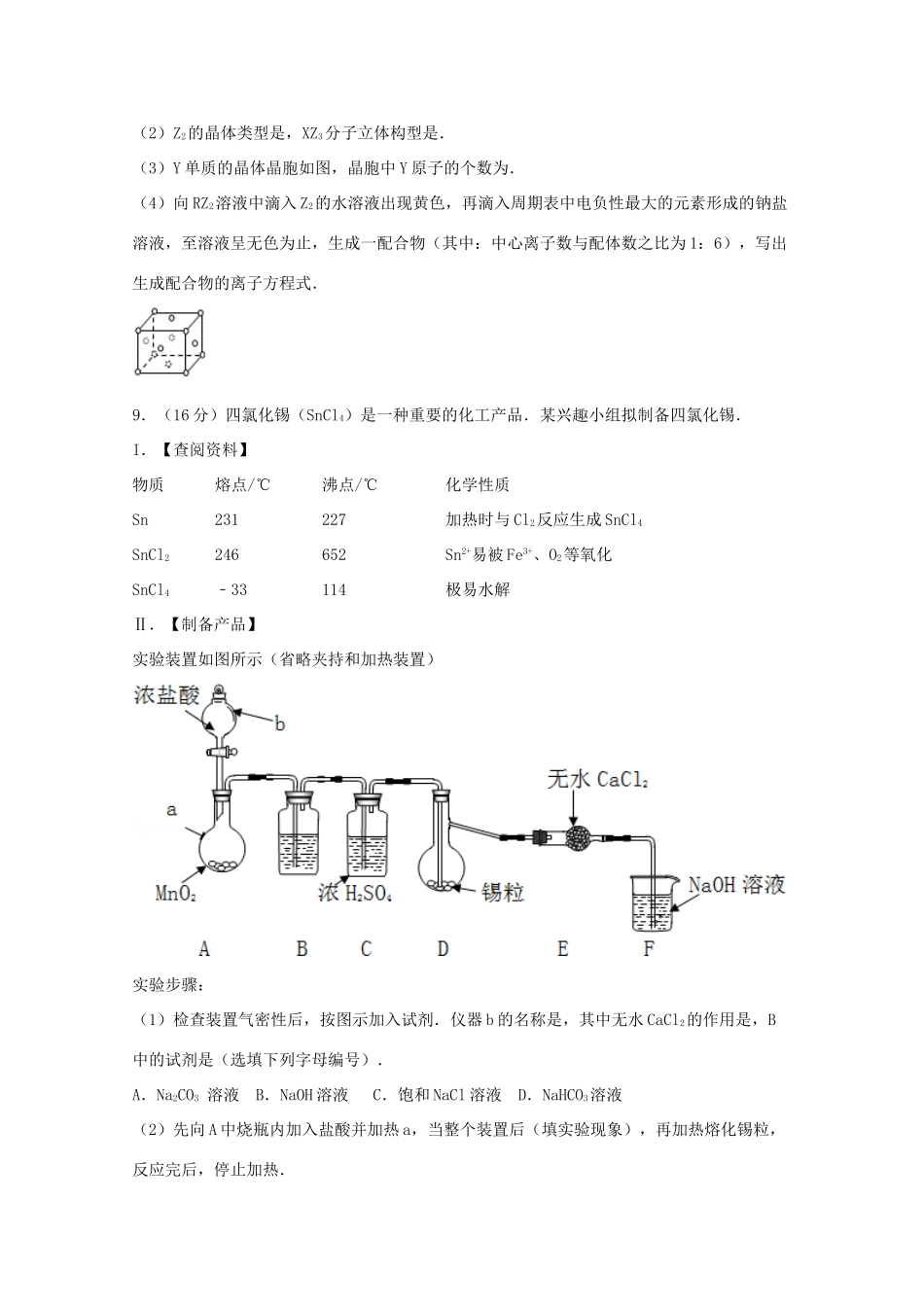
四川省内江市2015届高考化学三模试卷一、选择题(本大题共7小题,每小题6分,共42分.在每小题给出的四个选项中,只有一项符合题目要求)1.(6分)化学与生活密切相关,下列说法错误的是()A.含有重金属的电器废品不能随意丢弃,要分类回收并利用B.食品中都必须添加大量的化学防腐剂,使食品保质期更长久,C.采用加热消毒的目的是使蛋白质变性而杀灭细菌消毒D.使用乙醇作为汽油的代用品,可以减少汽车尾气中有害气体排放2.(6分)下列有关物质分类的说法正确的是()A.晶体硅、石墨都属于单质B.Na2O、Al2O3均为碱性氧化物C.醋酸、纯碱都属于强电解质D.水晶、水玻璃都属于盐3.(6分)下列有关说法错误的是()A.常用丁达尔效区分溶液与胶体B.在铜锌原电池中,负极上发生Zn﹣2e﹣═Zn2+C.常温下,稀释0.1mol/L的氨水,溶液中c(OH﹣)、c(NH4+)、c(H+)均减少D.向AgCl沉淀中滴加KI溶液,沉淀变为黄色,说明Ksp(AgCl)>Ksp(AgI)4.(6分)下列根据实验操作和现象所得出的结论不正确的是()选项实验操作实验现象结论A灼烧一小块铝箔熔化的铝并不滴落Al2O3的熔点高于AlB用洁净的铂丝蘸取某化合物少许,放在酒精灯外焰上灼烧火焰呈黄色该化合物中一定含钠元素C向溶液中滴加盐酸酸化的氯化钡溶液有白色沉淀产生该溶液一定含有SO42﹣离子D向KMnO4酸性溶液中滴加草酸溶液紫红色褪去草酸具有还原性A.AB.BC.CD.D5.(6分)下列解释事实的离子方程式正确的是()A.铁和稀硝酸反应制得浅绿色溶液:Fe+4H++NO3﹣═Fe3++NO↑+2H2OB.实验室盛碱液的瓶子不用玻璃塞:SiO2+2OH﹣═SiO32﹣+H2OC.用稀盐酸和大理石反应制取CO2:CO32﹣+2H+═CO2↑+H2OD.向Ca(ClO)2溶液中通入过量CO2制取次氯酸:2ClO﹣+H2O+CO2═2HClO+CO32﹣6.(6分)设NA代表阿伏加德罗常数,下列叙述正确的是()A.标准状况下,将5.6L的O2和5.6LNO的混合后的分子数约为0.5NAB.2L0.5mol/LBaCl2溶液中,阳离子所带电荷数为NAC.常温常压下,将0.2mol铝片投入含0.6molH2SO4的浓硫酸中,生成0.3NA个SO2分子D.42g丙烯气体中,含有的σ键数目为8NA7.(6分)温度为T℃时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g)⇌PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是()t/s050150250350n(PCl3)/mol00.160.190.200.20A.反应在前50s的平均速率为v(PCl3)=0.0032mol•L﹣1•s﹣1B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L﹣1,则反应的△H<0C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,达到平衡前v(正)>v(逆)D.相同温度下,起始时向容器中充入2.0molPCl5、2.0molCl2,达到平衡时,PCl5的转化率大于20%二、非选择题(共58分)8.(12分)X、Y、Z、R为前四周期元素,且原子序数依次增大.常温下X的氢化物XH3溶于水PH>7;Y是地壳里含量最多的金属元素,其单质与酸碱均能反应;Z2有毒,其水溶液有漂白性;R基态原子3d轨道的电子数是4S轨道的电子数的3倍,RZ2溶液呈浅绿色.回答下列问题:(1)Z的基态原子电子排布式为,X所在周期中原子半径最大的主族元素是.(2)Z2的晶体类型是,XZ3分子立体构型是.(3)Y单质的晶体晶胞如图,晶胞中Y原子的个数为.(4)向RZ2溶液中滴入Z2的水溶液出现黄色,再滴入周期表中电负性最大的元素形成的钠盐溶液,至溶液呈无色为止,生成一配合物(其中:中心离子数与配体数之比为1:6),写出生成配合物的离子方程式.9.(16分)四氯化锡(SnCl4)是一种重要的化工产品.某兴趣小组拟制备四氯化锡.I.【查阅资料】物质熔点/℃沸点/℃化学性质Sn231227加热时与Cl2反应生成SnCl4SnCl2246652Sn2+易被Fe3+、O2等氧化SnCl4﹣33114极易水解Ⅱ.【制备产品】实验装置如图所示(省略夹持和加热装置)实验步骤:(1)检查装置气密性后,按图示加入试剂.仪器b的名称是,其中无水CaCl2的作用是,B中的试剂是(选填下列字母编号).A.Na2CO3溶液B.NaOH溶液C.饱和NaCl溶液D.NaHCO3溶液(2)先向A中烧瓶内加入盐酸并加热a,当整个装置后(填实验现象),再加热熔...