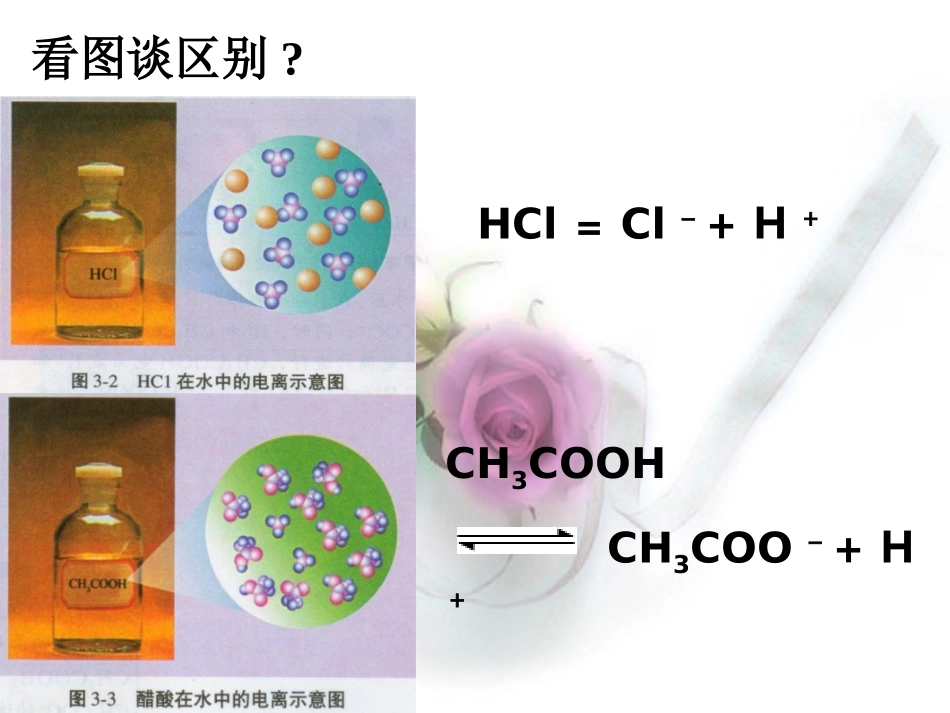
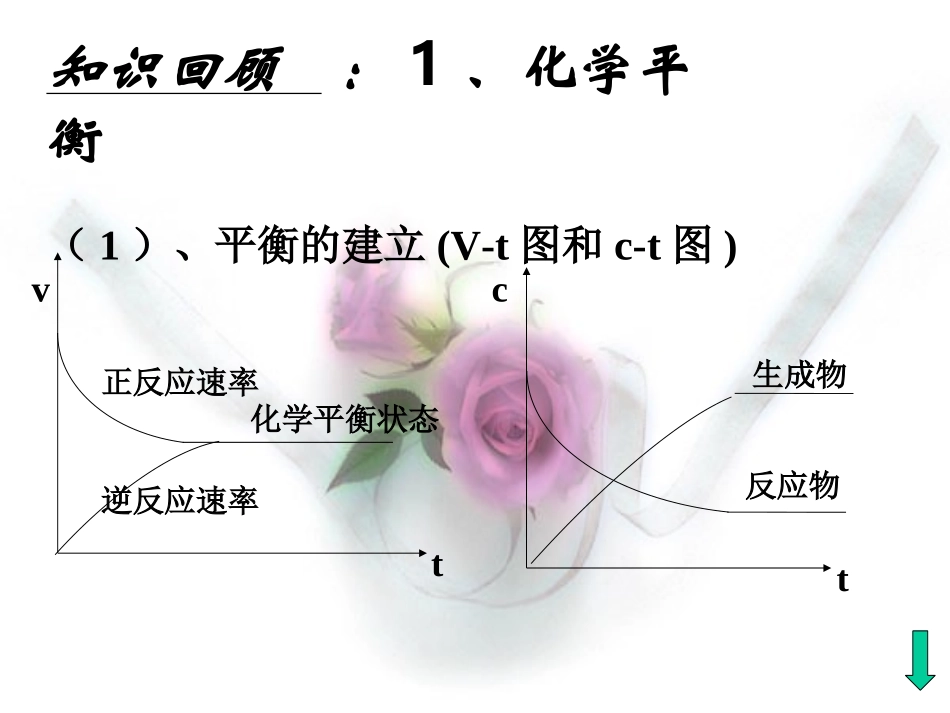
弱电解质的电离平衡HCl=Cl-+H+CH3COOHCH3COO-+H+看图谈区别?知识回顾:1、化学平衡(1)、平衡的建立(V-t图和c-t图)vt正反应速率逆反应速率化学平衡状态ct生成物反应物知识回顾:1、化学平衡(2)、化学平衡的概念可逆反应在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生改变,反应达到化学平衡状态。知识回顾:1、化学平衡(3)、化学平衡的特点逆:可逆反应动:动态平衡等:正反应速率和逆反应速率相等定:反应物和生成物的浓度保持恒定变:外界条件改变,原有平衡状态被破坏,一段时间后会达到新的平衡状态知识回顾:1、化学平衡(4)化学平衡的移动化学平衡移动原理(勒夏特列原理):改变影响化学平衡的一个因素,平衡将向能减弱这种改变的方向移动。化学反应的特点:(1)、是否为可逆反应?(2)、正反应微粒数增大还是微粒数减小?(3)、正反应吸热还是放热?具体对化学平衡可能产生影响的外界条件有:浓度:压强:温度:弱电解质电离平衡弱电解质电离平衡(以(以CHCH33COOHCOOH例)例)1、V-t图和c-t图Vt电离速率结合速率电离平衡状态ct分子浓度离子浓度弱电解质电离平衡弱电解质电离平衡2、电离平衡的概念电离平衡:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态。动电离平衡是一种动态平衡定条件不变,溶液中各分子、离子的浓度恒定不变。变条件改变时,电离平衡发生移动。等V电离=V结合≠0逆弱电解质的电离是可逆过程弱电解质电离平衡弱电解质电离平衡3、电离平衡的特点平衡移动规律平衡移动规律——勒沙特列原理勒沙特列原理弱电解质电离过程的反应特点:1、弱电解质的电离属于可逆过程2、电离方向是微粒数增多的方向;3、电离方向是吸热方向,弱电解质电离平衡弱电解质电离平衡(以(以CHCH33COOHCOOH例)例)44、电离平衡的移动、电离平衡的移动①温度:温度升高,平衡向右移动,电离程度增大弱电解质电离平衡弱电解质电离平衡(以(以CHCH33COOHCOOH例)例)影响电离平衡的因素影响电离平衡的因素②浓度:同离子效应离子反应效应加水稀释看一看!动画演示的是怎样的一个物理过程?改变条件平衡移动方向C(H+)C(CH3COO---)C(CH3COOH)加热加盐酸加NaOH加H3COONa加CH3COOH加水正向移动增大增大减少逆向移动增大减少增大正向移动减少增大减少逆向移动减少增大增大正向移动增大增大增大正向移动减少减少减少讨论完成表格:CH3COOHCH3COO--+H+知识回顾:2、化学平衡常数K对于可逆反应:aA+bBcC+dDcc(C)cd(D)K=ca(A)cb(B)(1)、表达式:(2)、意义:K值越大,可逆反应进行的程度越大。(3)、影响因素:内因:反应物的本性外因:温度二、弱电解质电离程度的表示:二、弱电解质电离程度的表示:11、电离平衡常数、电离平衡常数KK::Ka=c(H+).c(A-)c(HA)Kb=c(M+).c(OH-)c(MOH)对于一元弱酸:对于一元弱酸:HAHHAH+++A+A--,,平衡时平衡时对于一元弱碱:对于一元弱碱:MOHMMOHM+++OH+OH--,平衡时,平衡时(1)、K表达式:(3)、影响电离平衡常数大小的因素:A.电离平衡常数大小是由物质的本性决定的,在同一温度下,不同弱电解质的电离常数不同。B.与化学平衡常数一样,同一弱电解质的电离平衡常数只受温度影响,不受浓度影响。((22)、)、电离平衡常数意义:意义:在相同条件下,在相同条件下,KK值越大,弱电解质的电离程度越大,值越大,弱电解质的电离程度越大,相应酸相应酸((或碱或碱))的酸的酸((或碱或碱))性越强。性越强。知识回顾:3、平衡转化率α(1)、表达式:%100该反应物的起始浓度该反应物的平衡浓度该反应物的起始浓度(2)、意义:表示一定温度和一定起始浓度下反应进行的限度。(3)、影响因素:内因:反应物的本性外因:温度、反应物的浓度二、弱电解质电离程度的表示:二、弱电解质电离程度的表示:%100%100弱电解质分子总数数已电离的弱电解质分子弱电解质的初始浓度度已电离的弱电解质的浓2、弱电解质的电离度α:当弱电解质在溶液中达到电离平衡时,溶液中已经电离的电当弱电解质在溶液中达到...