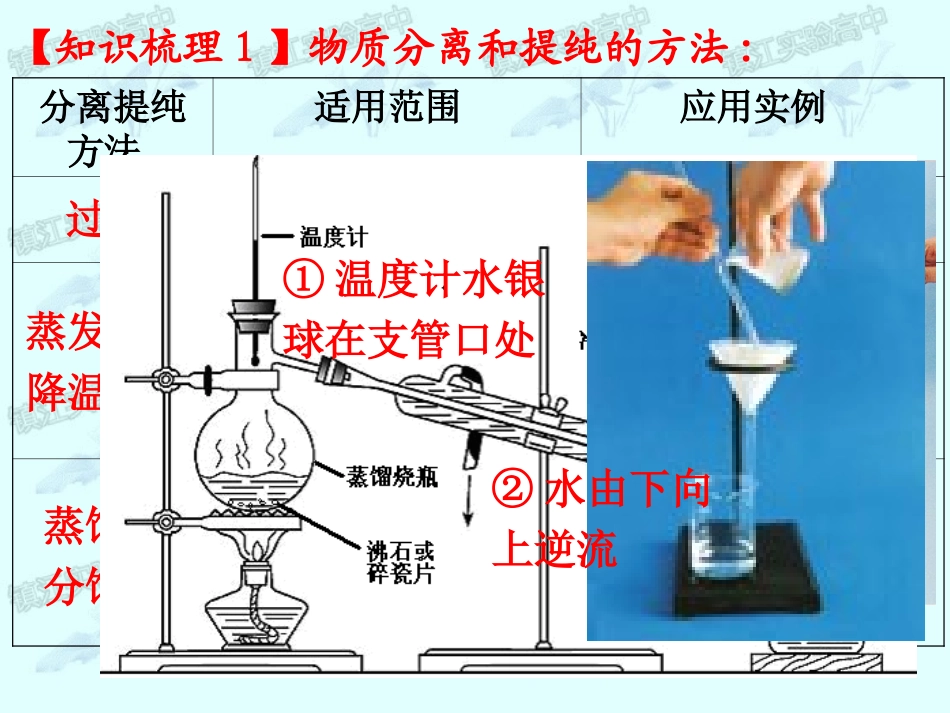
第二讲物质的分离、提纯和检验2014~2015化学学业水平测试复习【复习目标】1.初步学会常见物质的检验方法;了解钠、钾的焰色反应;2.初步学会使用过滤、蒸发等方法对混合物进行分离和提纯;3.初步学习蒸馏、萃取等分离和提纯的方法;4.初步学会Cl-、SO42-、CO32-、Fe3+、NH4+、Na+、K+等常见离子的检验方法。【知识梳理1】物质分离和提纯的方法:分离提纯方法适用范围应用实例固体与液体的混合物。粗盐的提纯①分离溶于水中的固体;②固体混合物中各成分的溶解度不同。①海水晒盐;②分离NaCl和KNO3的混合物①难挥发的固体杂质在液体中形成的混合物;②互溶液体沸点有明显差异。蒸馏水、无水乙醇的制备、石油的分馏过滤蒸发结晶降温结晶蒸馏或分馏①温度计水银球在支管口处②水由下向上逆流分离提纯方法适用范围应用实例溶质在互不相溶的溶剂里溶解度不同。利用CCl4从溴水中萃取溴两种互不混溶的液体混合物。CCl4和水的分离除去混合气体中的一种或多种杂质。除去CO2中混有的HCl萃取分液洗气长进短出上层液体上口倒,下层液体下口放。1、排水集气法2、向下排气集气法短进长出3、向上排气集气法气体收集法短进长出长进短出【例1】下列实验操作中,正确的是()A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热B.蒸馏操作时,应使温度计水银球浸入蒸馏烧瓶内的液体中C.分液操作时,首先打开分液漏斗上口活塞,再将下层液体从分液漏斗下口放出,上层液体也从下口放出D.萃取操作时,萃取剂应与原溶剂互不相溶(错,应该利用余热蒸干)(错,应该放在蒸馏烧瓶支管品处,测蒸气温度)(错,上层液体上口出,下层液体下口出)D【知识梳理2】常见离子的检验:H+①紫色石蕊溶液变红;②pH试纸测得pH<7。NH4+加NaOH溶液并加热,用湿润的红色石蕊试纸检验放出的气体,变蓝色。Al3+滴加NaOH溶液,首先产生白色沉淀,过量后沉淀溶解。Fe3+加KSCN溶液变成血红色。Na+、K+焰色反应:Na+呈黄色,K+透过蓝色钴玻璃观察为紫色。离子检验方法涉及方程式Al3++3OH-=Al(OH)3↓Al(OH)3+OH-=AlO2-+H2ONH4++OH-==NH3↑+H2O加热Fe3++3SCN-=Fe(SCN)3OH-①紫色石蕊溶液变蓝色;②酚酞溶液变红色;③用pH试纸测得pH>7。Cl-加AgNO3溶液产生白色沉淀,加稀硝酸不溶解。SO42-加盐酸酸化,再加入BaCl2溶液产生白色沉淀CO32-或HCO3-加盐酸产生无色、无味的气体,通入澄清石灰水产生白色沉淀。离子检验方法涉及方程式Ag++Cl-=AgCl↓Ba2++SO42-=BaSO4↓CO32-+2H+=H2O+CO2↑HCO3-+H+=H2O+CO2↑【例2】对于某些离子的检验及结论一定正确的是()A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32-B.加入氯化钡溶液有白色沉淀生成,加入盐酸,沉淀不消失,一定有SO42-C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+D.加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+C(错,可能含HCO3-/SO32-/HSO3-)(错,可能含Ag+)(错,可能有Ca2+)【例3】下列实验操作能达到实验目的的是()A.向尿液中加新制的Cu(OH)2并加热确定尿液中混有葡萄糖B.向碘水中加入酒精以萃取碘C.向酒精中加入金属钠确定酒精中混有醋酸D.将混有乙烯的甲烷气体通入酸性高锰酸钾以除去乙烯A(错,酒精与水互溶)(错,酒精也能与钠反应)(错,会产生CO2)【知识梳理3】常见有机物的检验方法:(1)葡萄糖:在一定条件下加入银氨溶液或新制氢氧化铜并加热,出现银镜或产生砖红色沉淀。(2)淀粉:加入碘水溶液变蓝色。(3)乙烯:通入酸性高锰酸钾溶液或溴水,溶液退色。【例4】下列除去杂质的方法正确的是()物质杂质试剂主要操作ASiO2Fe2O3盐酸过滤BCO2COO2点燃CFeCl2溶液FeCl3Cu过滤DNaHCO3Na2CO3加热A在大量CO2中CO不能燃烧会生成CuCl2碳酸氢钠变成碳酸钠【知识梳理4】除杂原理:1、除杂的方法:物理方法;化学方法。2、化学试剂的选择原则:(1)不增不减;(2)易分离。萃取溶沸点的差异结晶过滤物质溶解性的差异蒸馏分液课堂小结蒸发升华