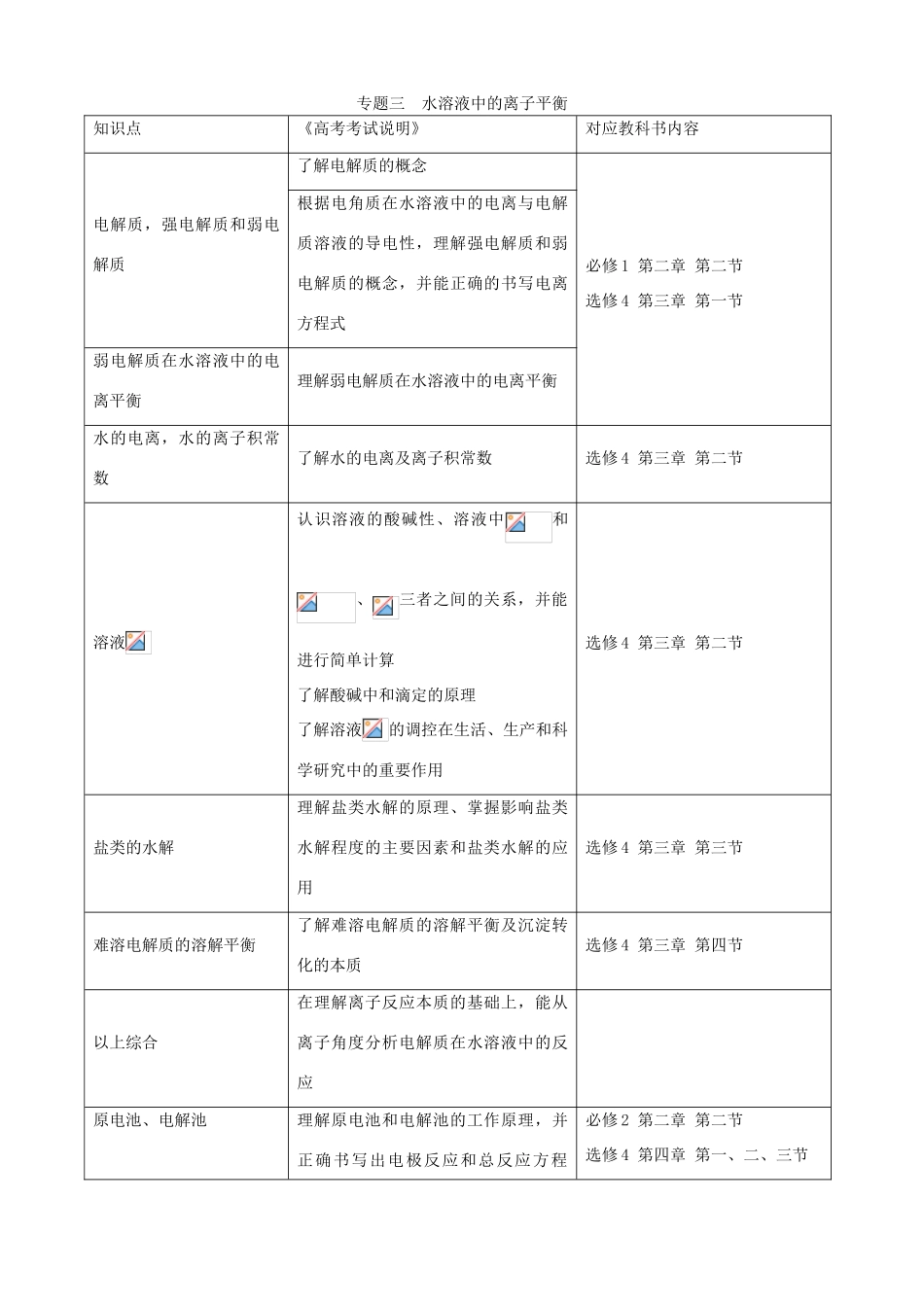
专题三水溶液中的离子平衡知识点《高考考试说明》对应教科书内容电解质,强电解质和弱电解质了解电解质的概念必修1第二章第二节选修4第三章第一节根据电角质在水溶液中的电离与电解质溶液的导电性,理解强电解质和弱电解质的概念,并能正确的书写电离方程式弱电解质在水溶液中的电离平衡理解弱电解质在水溶液中的电离平衡水的电离,水的离子积常数了解水的电离及离子积常数选修4第三章第二节溶液认识溶液的酸碱性、溶液中和、三者之间的关系,并能进行简单计算了解酸碱中和滴定的原理了解溶液的调控在生活、生产和科学研究中的重要作用选修4第三章第二节盐类的水解理解盐类水解的原理、掌握影响盐类水解程度的主要因素和盐类水解的应用选修4第三章第三节难溶电解质的溶解平衡了解难溶电解质的溶解平衡及沉淀转化的本质选修4第三章第四节以上综合在理解离子反应本质的基础上,能从离子角度分析电解质在水溶液中的反应原电池、电解池理解原电池和电解池的工作原理,并正确书写出电极反应和总反应方程必修2第二章第二节选修4第四章第一、二、三节式。了解原电池和电解池在实际中的应用电化学腐蚀能解释金属发生电化学腐蚀的原因,了解金属腐蚀的危害,和金属防护的措施选修1第三章第二节选修4第四章第四节一、知识整理电解质溶液理论包括弱电解质、弱电解质的电离和电离平衡;水的电离平衡,溶液的pH计算和溶液的酸碱性;盐溶液的酸、碱性和酸碱中和滴定;难溶电解质的溶解平衡;电化学知识。无机化学反应大多数是在水溶液中进行的。参与这些反应的物质主要是酸、碱和盐,它们都是电解质,在水溶液中能电离成水合离子,因此,酸、碱、盐之间在溶液中的反应实质上就是离子反应。充分运用化学平衡移动原理分析弱电解质在水溶液中的电离平衡,酸碱中和与盐类水解反应的平衡移动规律,联系实际讨论分析溶液的pH、盐类水解的应用。原电池、金属的腐蚀与防护和电解等知识在工农业生产和科学研究中的应用,是极为重要的。溶液中的离子平衡知识体系参见下表。二、重点知识解析1.溶液中的电离平衡(1)电解质、非电解质从化合物的结构认识电解质与非电解质。①电解质:离子化合物(熔化或溶于水)、极性共价化合物(溶于水)能电离生成自由移动的离子而导电。酸、碱、盐和部分金属氧化物属于电解质。②非电解质:部分共价化合物(熔化或溶于水)不电离因而不导电。非金属氧化物和大多数有机化合物属于非电解质。(2)强电解质、弱电解质①强、弱电解质的比较(等物质的量浓度):类型比较强电解质弱电解质物质类别离子化合物,极性共价化合物极性共价化合物离子浓度强碱、盐、强酸弱碱、弱酸、水离子浓度大小导电能力强弱电离程度完全(不可逆)部分(可逆)电离表示方式用“”用“”,存在电离平衡溶液中溶质微粒离子分子(多)、离子(少)离子方程式表示可溶:用离子;难溶:用化学式用分子式实例强碱:、……强酸:、……大多数盐:、……弱碱:……弱酸:、……②强、弱电解质的实例:氧化铝熔融态电离为和而导电,氧化铝是电解质。二氧化碳溶于水生成碳酸,碳酸电离生成和导电,碳酸是电解质、二氧化碳是非电解质。微溶强电解质:在反应物的溶液中可写为离子,如澄清石灰水中,已溶解的全部电离,在离子反应中用和表示。若是石灰乳,应该用化学式表示;在生成物中一般也写化学式。2.水的电离和溶液的(1)水是极弱的电解质。①水的电离:②水的离子积:常温时水中③影响因素:温度升高,,但水仍为中性。纯水中加入少量稀酸或稀碱[增大或],使水电离平衡逆向移动。纯水中加入弱酸盐或弱碱盐,因或,而促进水的电离平衡正向移动(盐类水解),并由此影响溶液酸、碱性。(2)溶液的酸碱性在稀的酸碱溶液中,常温水的离子积常数不变,因此:若溶液中,,,溶液呈酸性。若溶液中,,,溶液呈中性。若溶液中,,,溶液呈碱性。(3)溶液的。3.计算(1)强酸、强碱:,(为酸、碱的元数)。(2)强酸溶液,根据直接求;强碱溶液,先求,再根据求出后,再求。4.盐类水解(1)盐类水解实质在溶液中盐的弱酸阴离子或弱碱阳离子跟水电离出来的或结合生成弱酸、弱碱的反应。(2)结果水的电离平...