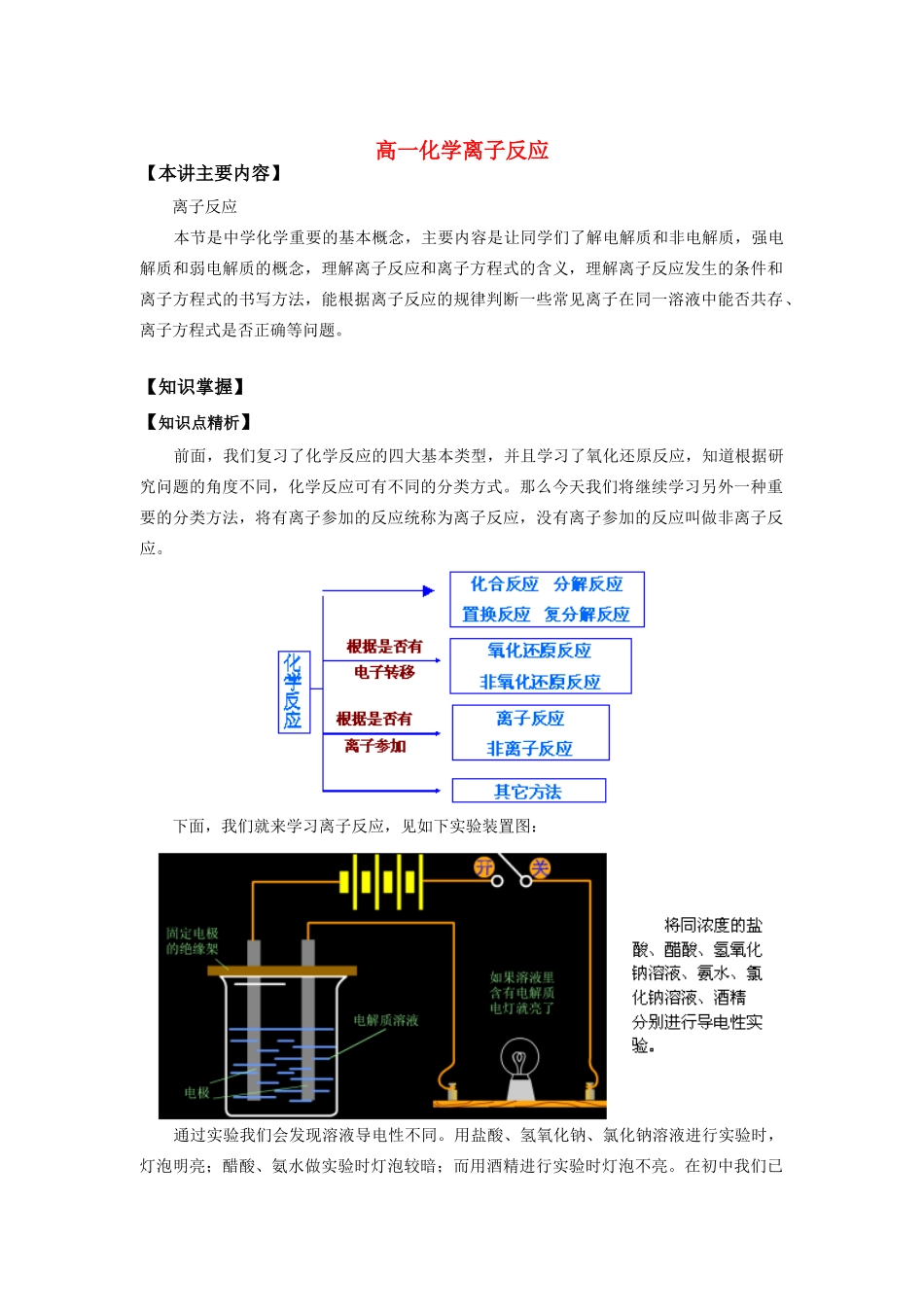
高一化学离子反应【本讲主要内容】离子反应本节是中学化学重要的基本概念,主要内容是让同学们了解电解质和非电解质,强电解质和弱电解质的概念,理解离子反应和离子方程式的含义,理解离子反应发生的条件和离子方程式的书写方法,能根据离子反应的规律判断一些常见离子在同一溶液中能否共存、离子方程式是否正确等问题。【知识掌握】【知识点精析】前面,我们复习了化学反应的四大基本类型,并且学习了氧化还原反应,知道根据研究问题的角度不同,化学反应可有不同的分类方式。那么今天我们将继续学习另外一种重要的分类方法,将有离子参加的反应统称为离子反应,没有离子参加的反应叫做非离子反应。下面,我们就来学习离子反应,见如下实验装置图:通过实验我们会发现溶液导电性不同。用盐酸、氢氧化钠、氯化钠溶液进行实验时,灯泡明亮;醋酸、氨水做实验时灯泡较暗;而用酒精进行实验时灯泡不亮。在初中我们已经了解了溶液导电是靠自由移动的离子,于是我们把化合物在一定的条件下离解成自由移动离子的过程叫做电离,而根据化合物的电离的不同我们可将化合物分成电解质和非电解质。我们把这种在水溶液里或熔融状态下能够导电的化合物叫做电解质,如:酸、碱、盐。[讨论]下列物质中哪些是电解质?Cu、NaCl固体、NaOH固体、K2SO4溶液、CO2、蔗糖、NaCl溶液、H2O、酒精。[小结]应注意以下几点:①电解质应是化合物。而Cu则是单质,K2SO4与NaCl溶液都是混合物。②电解质应是一定条件下本身电离而导电的化合物。而CO2能导电是因CO2与H2O反应生成了H2CO3,H2CO3能够电离而非CO2本身电离。所以CO2不是电解质。③酸、碱、盐、水是电解质,蔗糖、酒精为非电解质。通过上面的实验我们还发现,相同条件下,不同种类的酸、碱、盐溶液的导电能力也不相同。电解质溶液导电能力的大小决定于溶液中自由移动的离子的浓度和离子所带电荷数。而当溶液体积、浓度和离子所带的电荷数都相同的情况下,取决于溶液中自由移动离子数目,导电能力强的溶液里的自由移动的离子数目一定比导电能力弱的溶液里的自由移动的离子数目多。显然,在CH3COOH、NH3•H2O溶液中的自由移动离子数目较少。可见溶液中自由移动的离子多少跟电解质的电离程度有关。因此,我们把在水溶液中全部电离成离子的电解质叫做强电解质,而在水溶液中只一部分电离成离子的电解质叫做弱电解质。为便于记忆,我将这些概念总结成如下表格:[讨论]BaSO4、CaCO3、AgCl等难溶于水的盐是否属电解质?CH3COOH易溶,是否属强电解质?[小结]BaSO4、CaCO3、AgCl虽然难溶,但溶解的极少部分却是完全电离,所以它们为强电解质CH3COOH易溶于水,但它却不能完全电离,所以属弱电解质。因此,电解质的强弱跟其溶解度无必然联系,本质区别在于它们在水溶液中的电离程度。[资料]强电解质和弱电解质的区别(以下数据是在20ºC测定)表示电解质电离的化学方程式叫电离方程式:HCl=H++Cl-H2SO4=2H++SO42-NaCl=Na++Cl-CH3COOHCH3COO-+H+[总结]通过前面的学习我们已经知道,电解质包括酸、碱、盐、活泼金属的氧化物和水等。这些物质在水溶液中或熔融状态可以电离出自由离子,在这种情况下发生的大多数反应有离子参加,请看下面实验:演示实验:[实验分析]第一支试管没有发生明显变化,为什么?因为生成物中无沉淀、气体、难电离物生成(不符合复分解反应的条件。)第二支试管中溶液依然是蓝色,说明铜离子没有发生反应,只有硫酸根和钡离子发生了反应,推断:氯离子也没有反应。第三只试管中溶液中的氯离子和银离子发生了反应,但是溶液依然是蓝色,说明铜离子依然没有发生反应。[总结]第二支试管中CuSO4溶液与BaCl2溶液反应的实质是Ba2+与SO42-离子之间的反应;可表示成:Ba2++SO42-=BaSO4↓第三只试管中氯离子和银离子发生了反应可表示成:Ag++Cl—=AgCl↓于是我们定义在溶液中(或熔化状态下)有离子参加或生成的反应叫离子反应,用实际参加反应的离子来表示的反应叫离子方程式。下面我们就介绍一下离子方程式书写的方法和意义:一.离子方程式书写的方法:(初学者可采用下列步骤书写离子方程式)1.正确写出反应的化...