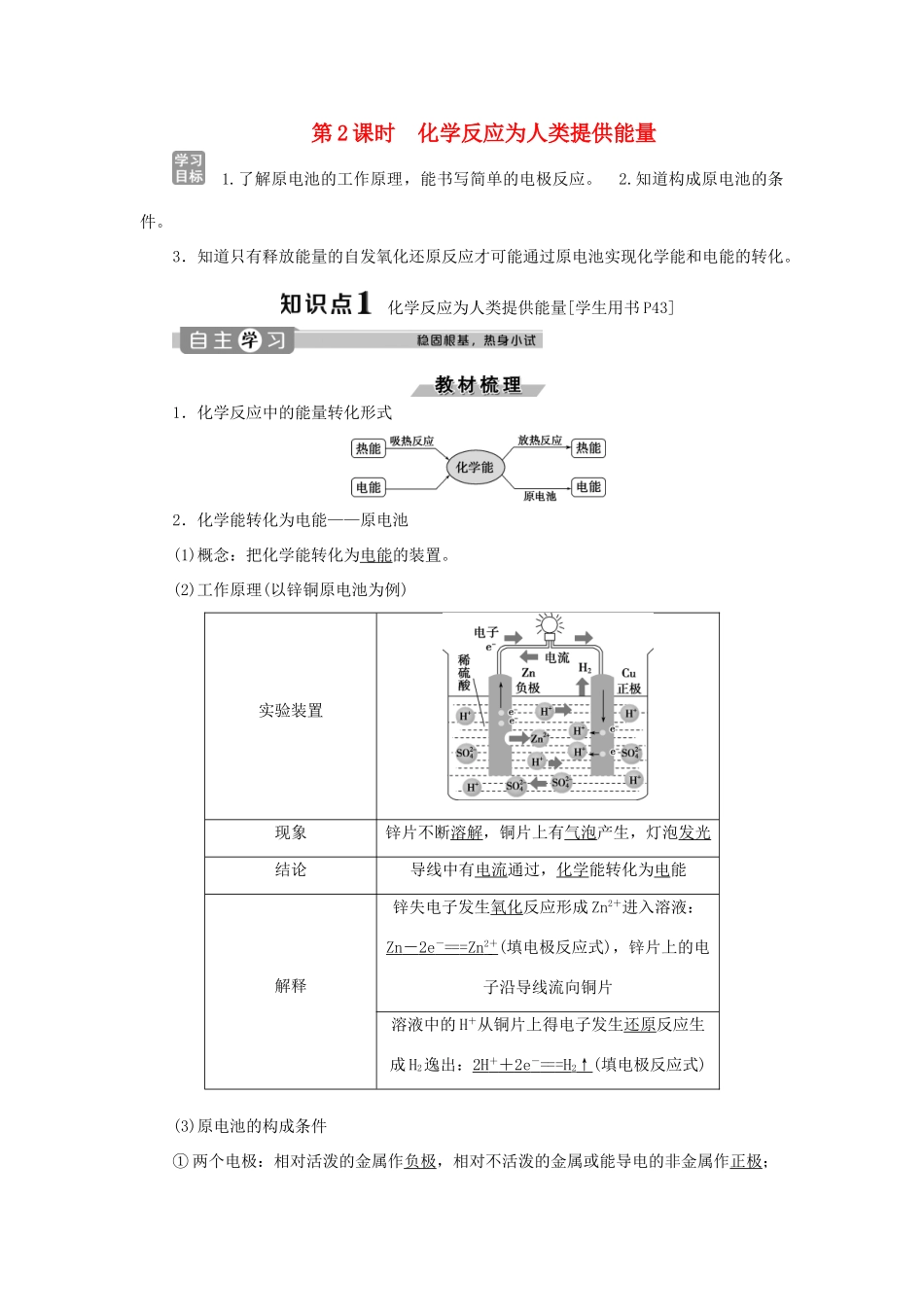
第2课时化学反应为人类提供能量1.了解原电池的工作原理,能书写简单的电极反应。2.知道构成原电池的条件。3.知道只有释放能量的自发氧化还原反应才可能通过原电池实现化学能和电能的转化。化学反应为人类提供能量[学生用书P43]1.化学反应中的能量转化形式2.化学能转化为电能——原电池(1)概念:把化学能转化为电能的装置。(2)工作原理(以锌铜原电池为例)实验装置现象锌片不断溶解,铜片上有气泡产生,灯泡发光结论导线中有电流通过,化学能转化为电能解释锌失电子发生氧化反应形成Zn2+进入溶液:Zn-2e-===Zn2+(填电极反应式),锌片上的电子沿导线流向铜片溶液中的H+从铜片上得电子发生还原反应生成H2逸出:2H++2e-===H2↑(填电极反应式)(3)原电池的构成条件①两个电极:相对活泼的金属作负极,相对不活泼的金属或能导电的非金属作正极;②一个溶液:两个电极插入电解质溶液中;③一个回路:用导线连接成闭合回路或直接接触。(4)常见电池①干电池:又称一次电池,如锌锰干电池。②蓄电池:又称二次电池,如铅蓄电池。③燃料电池:能量转化率高,无污染。1.判断正误(1)所有的化学反应均能设计成原电池。()(2)原电池的负极金属一定比正极金属活泼。()(3)原电池的负极一定发生氧化反应。()(4)原电池工作时,电子通过电解质溶液由正极移向负极。()(5)原电池工作时,正极一定产生气体。()(6)原电池中化学能全部转变为电能。()(7)原电池的两极只能用金属材料。()答案:(1)×(2)×(3)√(4)×(5)×(6)×(7)×2.下列装置能构成原电池的是(连接两个电极的均是金属导线)()解析:选D。A中两极金属活泼性相同;B中无电解质溶液;C中没构成闭合回路。3.已知空气-锌电池的电极反应为锌片:Zn+2OH--2e-===ZnO+H2O;碳棒:O2+H2O+2e-===2OH-,据此判断,锌片是()A.正极并被还原B.正极并被氧化C.负极并被还原D.负极并被氧化解析:选D。由电极反应式:Zn+2OH--2e-===ZnO+H2O可知,Zn失电子发生氧化反应,作负极。1.原电池的工作原理工作过程中电解质溶液中阳离子向正极移动(如H+向Cu片定向移动),阴离子向负极移动(如SO向Zn片定向移动);与外电路构成闭合回路。2.原电池正、负极判断(从5个角度思考判断)一般而言,原电池负极金属活泼性大于正极金属,但也有特例,如MgAlNaOH(aq)原电池中,Mg作正极,Al作负极;FeCu浓HNO3原电池中,Fe作正极,Cu作负极。锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是()A.铜电极上发生氧化反应B.电池工作一段时间后,甲池的c(SO)减小C.电池工作一段时间后,乙池溶液的总质量增加D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡[解析]A.Cu作正极,电极上发生还原反应,错误;B.电池工作过程中,SO不参加电极反应,故甲池的c(SO)基本不变,错误;C.电池工作时,甲池反应为Zn-2e-===Zn2+,乙池反应为Cu2++2e-===Cu,甲池中Zn2+会通过阳离子交换膜进入乙池,以维持溶液中电荷平衡,由电极反应式可知,乙池中每有64gCu析出,则进入乙池的Zn2+为65g,溶液总质量略有增加,正确;D.由题干信息可知,阴离子不能通过阳离子交换膜,错误。[答案]C(1)上述例题的原电池装置中,ZnSO4(aq)与CuSO4(aq)能否互换?(2)上述例题的原电池装置中,电子如何流动?答案:(1)不能。(2)电子从Zn电极经导线流向Cu电极。原电池的工作原理1.某原电池结构如图所示,下列有关该原电池的说法正确的是()A.总电池反应为Mg+2H+===Mg2++H2↑B.镁棒发生还原反应C.电子从铜棒经外电路流向镁棒D.铜棒为负极解析:选A。A.镁比铜活泼,镁作负极,其总电池反应为Mg+2H+===Mg2++H2↑,故正确;B.镁失去电子,化合价升高,被氧化,发生氧化反应,故错误;C.根据原电池工作原理,电子从镁经外电路流向铜,故错误;D.镁化合价升高,作负极,故错误。2.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示()A.铜棒的质量B.c(Zn2+)C.c(H+)D.c(SO)解析:选C。图2显示,在铜锌原电池中,随着流入正极的电子的物质的量(x)的增加,y逐渐减小。该铜锌...