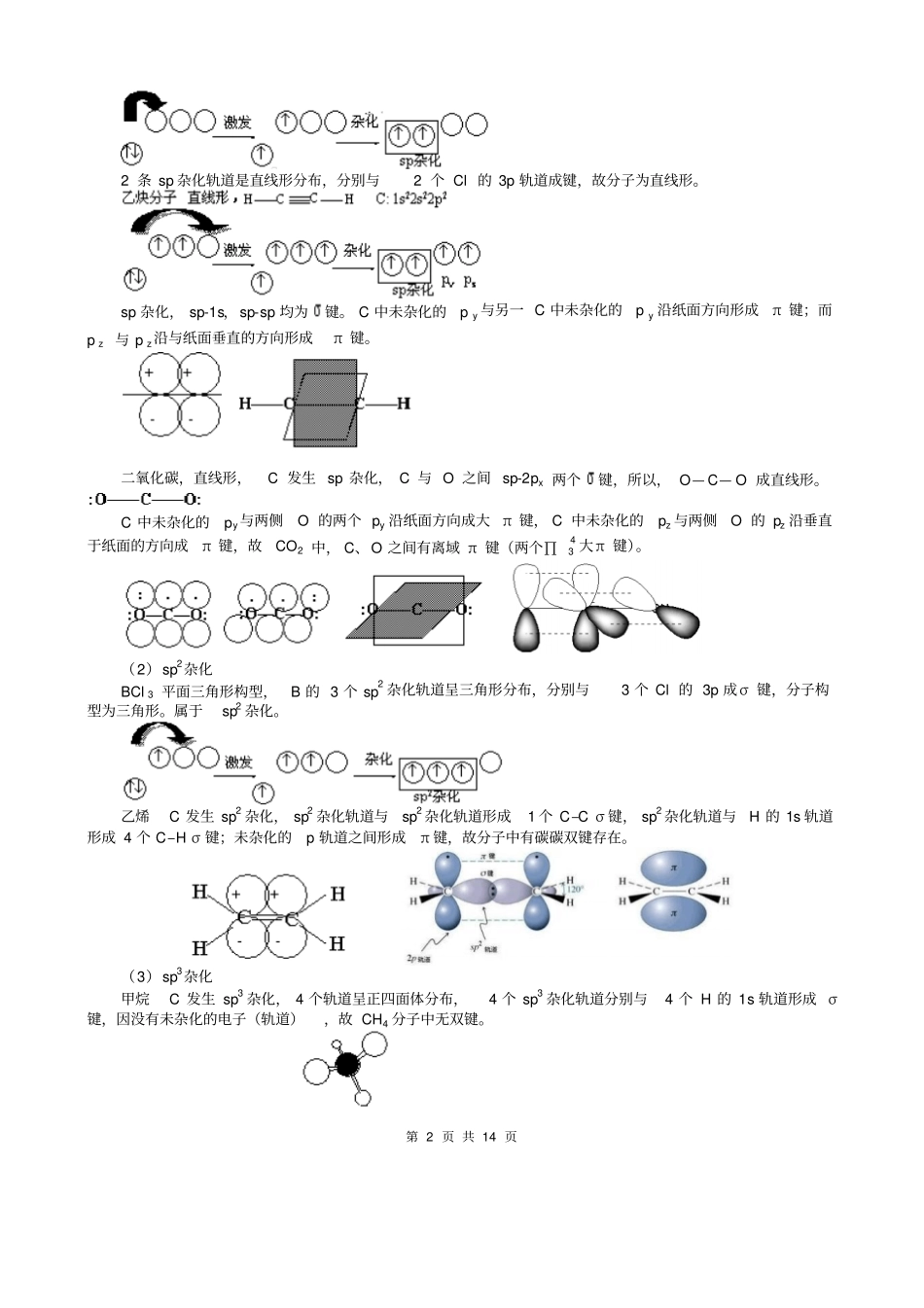
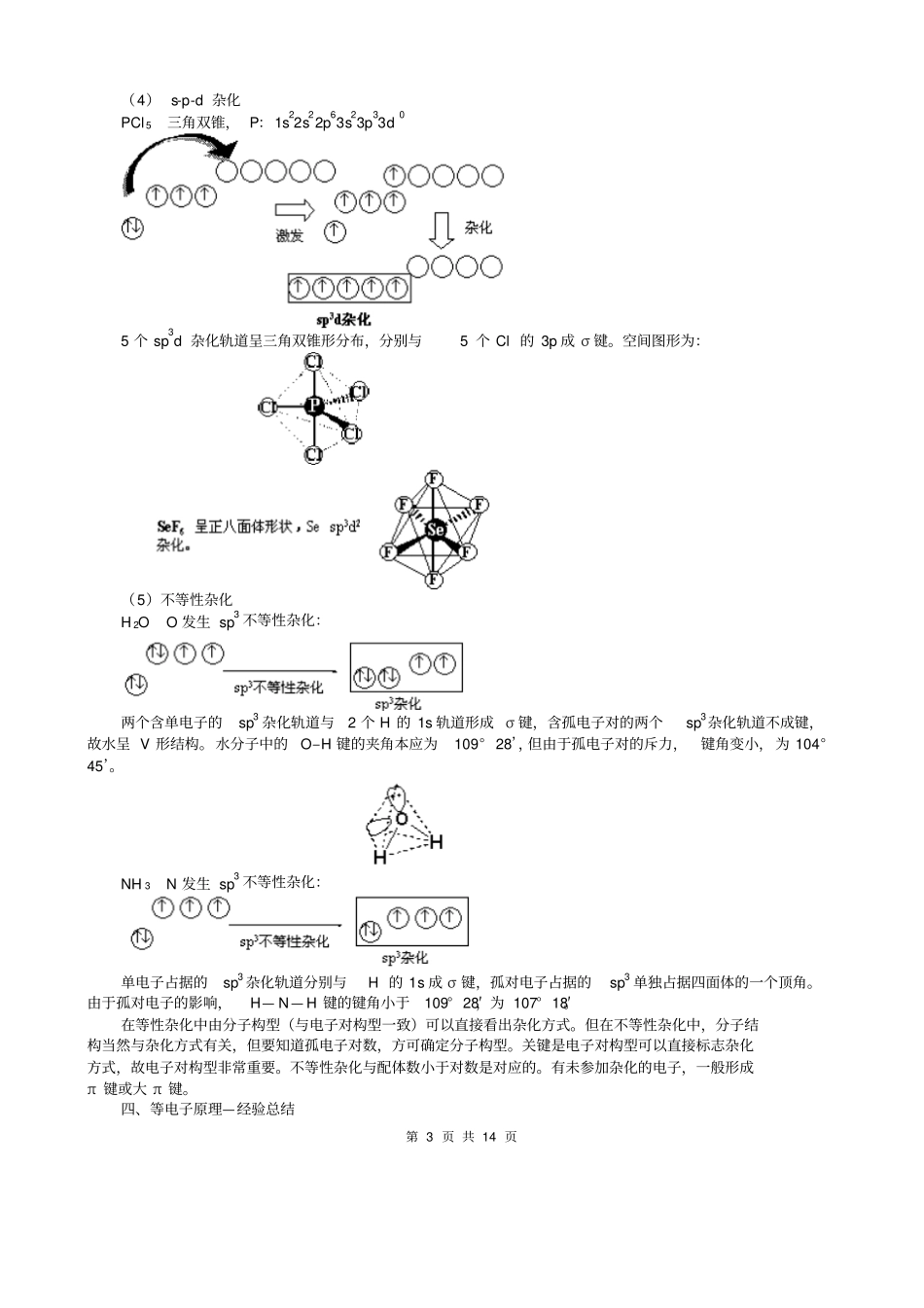
第 1 页 共 14 页选修三第二章第 2 节分子的立体构型三、杂化轨道理论1.杂化轨道理论认为:在形成分子时,通常存在激发、杂化、轨道重叠等过程。但应注意,原子轨道的杂化,只有在形成分子的过程中才会发生,而孤立的原子是不可能发生杂化的。同时只有能量相近的原子轨道 (如 2s,2p 等)才能发生杂化,而1s 轨道与 2p 轨道由于能量相差较大,它是不能发生杂化的。杂化:成键过程是由若干个能量相近的轨道经叠加、混合、重新调整电子云空间伸展方向,分配能量形成新的杂化轨道过程。2、理论要点:①成键原子中几个能量相近的轨道杂化成新的杂化轨道;②参加杂化的原子轨道数= 杂化后的杂化轨道数。总能量不变;③杂化时轨道上的成对电子被激发到空轨道上成为单电子,需要的能量可以由成键时释放的能量补偿。3、杂化轨道的种类(1)按参加杂化的轨道分类s- p 型: sp 杂化、 sp2 杂化和 sp3 杂化s- p-d 型: sp3 d 杂化、sp3 d2 杂化(2)按杂化轨道能量是否一致分类等性杂化 , 如 C 的 sp3 杂化:4 个 sp3 杂化轨道能量一致。形成 3 个能量相等的sp2 杂化轨道,属于等性杂化。判断是否是等性杂化,要看各条杂化轨道的能量是否相等,不看未参加杂化的轨道的能量。4、各种杂化轨道在空间的几何分布杂化类型sp3sp2spsp3d 或 dsp3sp3d2 或 d2sp3立体构型正四面体正三角形直线形三角双锥体正八面体杂化轨道成键时,要满足化学键间最小排斥原理,键与键间排斥力大小决定于键的方向,即决定于杂化轨道间的夹角。由于键角越大化学键之间的排斥力越小,对sp 杂化来说,当键角为180° 时,其排斥力最小, 所以 sp 杂化轨道成键时分子呈直线形;对 sp2 杂化来说, 当键角为 120° 时,其排斥力最小, 所以 sp2杂化轨道成键时,分子呈平面三角形。由于杂化轨道类型不同,杂化轨道夹角也不相同,其成键时键角也就不相同,故杂化轨道的类型与分子的空间构型有关。5、用杂化轨道理论解释构型(1)sp 杂化BeCl 2 分子,直线形,用杂化轨道理论分析其成键情况,说明直线形的原因。Be: 1s22s22p0sp 杂化 : 第 2 页 共 14 页2 条 sp 杂化轨道是直线形分布,分别与2 个 Cl 的 3p 轨道成键,故分子为直线形。sp 杂化, sp-1s,sp-sp 均为键。 C 中未杂化的p y 与另一 C 中未杂化的p y 沿纸面方向形成π 键;而p z 与 p z沿与纸面垂直的方向形成π 键。二氧化碳,直线...