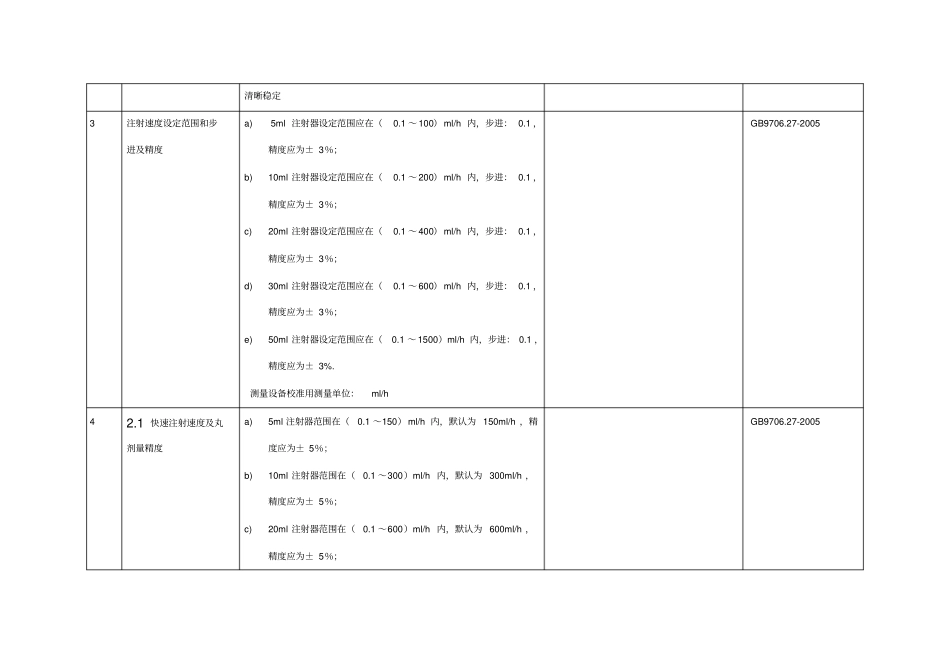
研 究 资 料(资料 5)5、概述产品名称: xxx 产品型号: xxx公司名称: xxx 有限公司日期: 2014 年 10 月管理类别: xxxx本研究报告遵循了《医疗器械注册申报资料要求和批准证明文件格式》(第 43 号)的编写要求,以xxx 有关的国家强制标准和行业标准作为研究依据,按产品分类要求和产品自身特性进行研究分析,因本xxx 属于有源Ⅱ类(6854)产品,不包含注射器,没有接触患者的部件和附件,所以其中部份内容不适用和 / 或属于豁免目录产品(如生物兼容性、生物安全性、灭菌和消毒工艺、动物研究等)。本报告主要针对产品性能、有效期和包装、软件等研究分析。5.1 产品性能研究5.1.1 产品技术要求的编制说明本 xxx 是由 xxx 有限公司负责设计、研发和生产。本xxx 用于向病人xxx,或者用于化学科研和生物医学研究。根据《医疗器械监督管理条例》和《医疗器械注册管理办法》的相关规定,医疗器械应具有安全性、有效性;为此,我们参考GB9706.27-2005《医用电气设备第 2-24 部分: 输液泵和输液控制器安全专用要求》的基础上, 结合 GB 9706.1-2007《医用电气设备第 1 部分: 安全通用要求》 、 GB/T 14710-2009《医用电器环境要求及试验方法》和 YY0505-2012 《医用电气设备第1-2 部分安全通用要求-并列标准电磁兼容-要求和试验方法》的规 定 ,并 遵循了《关于发布医疗器械产品技术要求编写指导原则的通告》(第9 号通告)所要求的格式编写,制定了产品技术要求,规定了xxx 性能指标和电气安全要求的检验标准和依据。5.1.2 引用及主要性能指标确定的依据GB/T 191-2008 包装贮运图示标志GB 9706.1-2007 医用电气设备第 1 部分:安全通用要求GB 9706.27-2005 医用电气设备第 2-24 部分:输液泵和输液控制器安全专用要求GB/T 14710-2009 医用电器环境要求及试验方法YY0505-2012 医用电气设备第1-2 部分安全通用要求-并列标准电磁兼容-要求和试验方法YY/T 0316-2008 医疗器械风险管理对医疗器械的应用YY/T 0466.1-2009 医疗器械用于医疗器械标签、标记和提供信息的符号第 1 部分:通用要求YY 0709-2009 医用电器设备第1-8部分:安全通用要求并列标准:通用要求,医用电器设备和医用电器系统中报警系统的测试和指南5.1.3 产品技术指标序号试验项目技术指标检测方法确定依据1外观xxx 主机的外表面应光滑整洁、色泽均匀、无划痕、破损、变形等缺陷。xxx 主机上的文字、标识应...