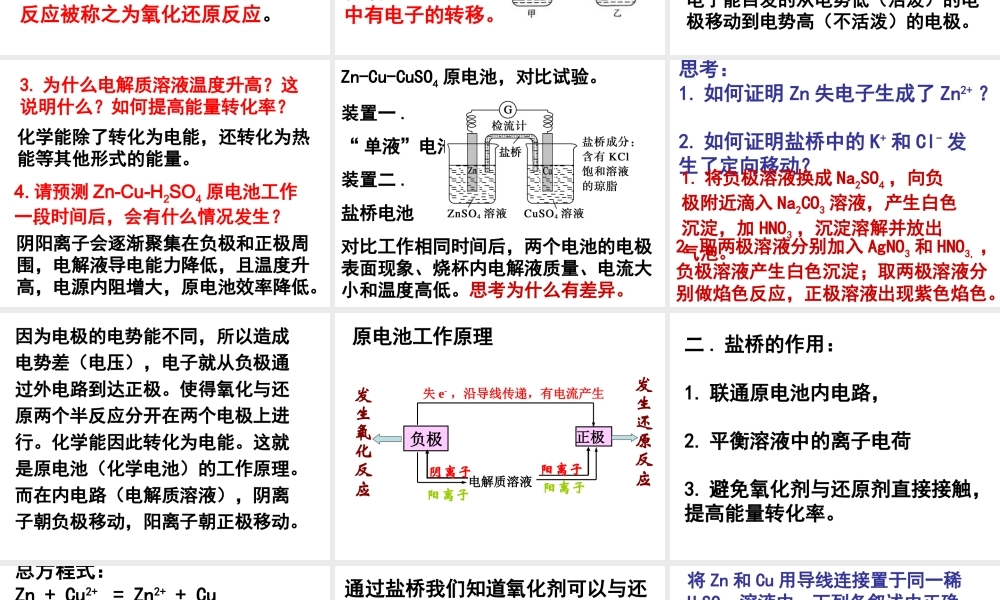
第一节 原电池 下列各图所示装置属于原电池的是( ) C 下列关于原电池的叙述正确的是A. 若负极质量减轻,则正极质量一定增加。B. 原电池中发生的反应不一定是氧化还原反应,但是一定是放热反应C. 构成原电池的两个电极必须是两种活动性不同的导体D. 理论上所有氧化还原反应都能设计成原电池E. 电子从内电路的正极移动到负极 C 一 . 原电池原理1. 定义: 将化学能转化成电能的装置。 2. 构成条件:( 1 )活动性不同的两个导电电极( 2 )电极和溶液间能自发的发生 氧化还原反应( 3 )形成闭合回路 无机化学反应一般分为两大类,一类是在反应过程中,反应物之间没有电子的转移或得失,如酸碱反应、沉淀反应,它们只是离子或原子间的相互交换;另一类则是在反应过程中,反应物之间发生了电子的得失或转移,这类反应被称之为氧化还原反应。 我们如何知道氧化还原反应有电子转移呢?请大家回顾必修 2 的电化学对比实验。 Zn 与 Cu 单独插入稀硫酸;Zn 与 Cu 通过电流表插入稀硫酸。原电池反应非常直观的告诉我们在氧化还原反应中有电子的转移。 思考:1. 为什么是在不失去电子的金属上放出气泡?这说明什么?2. 为什么电子会自发的从一个电极移动到另一个电极呢?原电池反应告诉我们氧化与还原两个半反应可以同时但是不同地方发生。电子能自发的从电势低(活泼)的电极移动到电势高(不活泼)的电极。 3. 为什么电解质溶液温度升高?这说明什么?如何提高能量转化率?4. 请预测 Zn-Cu-H2SO4 原电池工作一段时间后,会有什么情况发生?化学能除了转化为电能,还转化为热能等其他形式的能量。阴阳离子会逐渐聚集在负极和正极周围,电解液导电能力降低,且温度升高,电源内阻增大,原电池效率降低。 Zn-Cu-CuSO4 原电池,对比试验。装置一 .“ 单液”电池装置二 . 盐桥电池对比工作相同时间后,两个电池的电极表面现象、烧杯内电解液质量、电流大小和温度高低。思考为什么有差异。 思考:1. 如何证明 Zn 失电子生成了 Zn2+ ?2. 如何证明盐桥中的 K+ 和 Cl- 发生了定向移动?1. 将负极溶液换成 Na2SO4 ,向负极附近滴入 Na2CO3 溶液,产生白色沉淀,加 HNO3 ,沉淀溶解并放出气泡。2. 取两极溶液分别加入 AgNO3 和 HNO3, ,负极溶液产生白色沉淀;取两极溶液分别做焰色反应,正极溶液出现紫色焰色。 因为电极的电势能不同,所以造成电势差(电压),电子就从负极通过外电路...