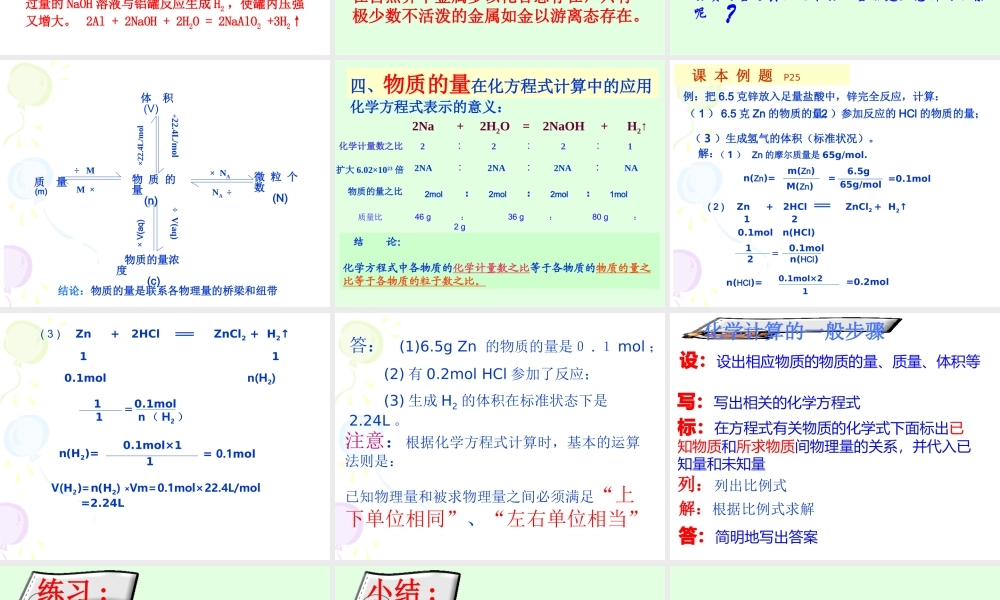
第三章 金属及其化合物第一节 金属的化学性质 (第三课时)仁怀四中 王波通过金属化学性质的学习,同学们已经知道,根据金属活动性顺序表( H )前面的金属都能与酸反应产生 H2 ,这是金属的通性。有没有金属能与碱溶液反应三、铝与氢氧化钠溶液的反应实验探究:实验 3-41. 铝与稀盐酸的反应化学方程式为 :2Al + 6HCl == 2AlCl3 + 3H2 离子方程式为 :2Al+6H+==2Al3+ +3H22. 铝与氢氧化钠溶液的反应2Al+2NaOH+2H2O==2NaAlO2+3H2 偏铝酸钠2Al+2OH-+2H2O==2AlO2- + 3H2实验现象 :铝和盐酸、 NaOH 溶液反应都有气泡产生,将点燃的木条放在试管口,可听到到轻微的爆鸣声。通过这个实验,我们知道铝既能跟酸反应又能跟强碱溶液反应产生 H2 ,这说明铝是一种非常特殊的金属。学以致用 生活常识为什么铝制餐具不能用来蒸煮或长时间存放酸性、碱性的食物 ? 解释:酸、碱和盐等可以直接浸湿铝的保及铝制品本身,所以,铝制餐具不宜用来蒸煮或长期存放酸性、碱性或咸的食物。1. 向一个铝制易拉罐内充满 CO2, 然后往罐中注入足量的 NaOH 溶液 , 立即用胶布严封罐口 , 不一会儿听到罐内“咔咔”作响,发现易拉罐变瘪,再过一会儿易拉罐又鼓起来。( 1 )易拉罐变瘪的原因是什么?写出反应方程式; ( 2 )易拉罐又鼓起来的原因是什么?写出反应方程式。 NaOH 溶液吸收 CO2 ,罐内压强减小,外界压强将易拉罐压瘪。 CO2 + 2NaOH = Na2CO3 + H2O过量的 NaOH 溶液与铝罐反应生成 H2 ,使罐内压强又增大。 2Al + 2NaOH + 2H2O = 2NaAlO2 +3H2↑动动脑?以上我们学习了金属的一些化学性质,通过分析不难发现,在反应中这些金属元素的化合价都从 0 价升为正价。在这些变化中,多数金属表现了强的还原性,做还原剂在自然界中金属多以化合态存在,只有极少数不活泼的金属如金以游离态存在。金在自然界中以游离态存在刚才,我们定性研究了铝的化学性质。工农业生产当中更需要了解、掌握反应的定量问题,这就涉及到运用有关物理量进行计算的问题 , 我们已学习哪些物理量? 质量、物质的量、物质的量浓度、微粒个数、气体的体积 m n c N V物质的量与其他几个物理量能建立怎样的联系呢 ?结论:物质的量是联系各物理量的桥梁和纽带物 质 的 量 (n) 质 量 (m)微 粒 个 数 (N) 体 积 (V) 物质的量浓度 (c) M ×÷ M× NA NA ÷÷22.4L/mol×22.4L/mol÷ V(aq)× V(a...