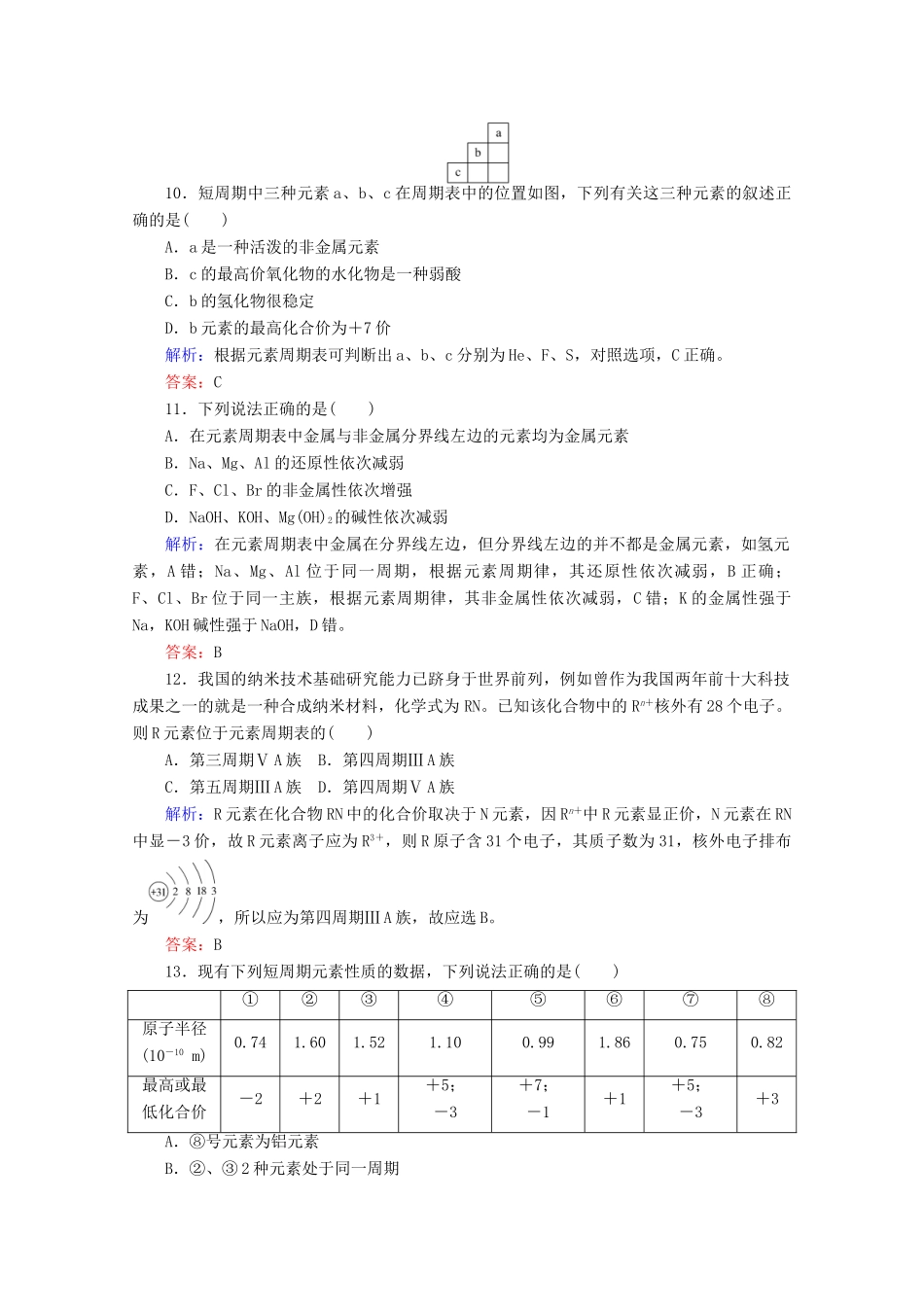
课时作业 18 元素周期律 [学业达标]1.对于第 2 周期元素从左到右(稀有气体元素除外),下列说法中不正确的是( )A.原子半径逐渐减小B.最外层电子数逐渐增多C.最高正化合价逐渐升高D.元素的非金属性逐渐增强答案:C2.下列关于微粒半径的说法正确的是( )A.电子层数少的元素原子半径一定小于电子层数多的元素原子半径B.核外电子层结构相同的单核微粒其半径相同C.质子数相同的不同单核微粒,电子数越多半径越大D.原子序数越大,原子半径越大解析:Li 的原子半径大于 Cl 的原子半径,A、D 两项错误;对于核外电子层结构相同的单核离子和原子,其半径是不同的,B 项错误。答案:C3.已知几种元素的原子半径如下表所示。原子PClOF半径/pm110996664根据以上数据,推测 S 原子的半径可能是( )A.88 pm B.104 pmC.71 pm D.40 pm解析:由元素周期律可知,S 原子的半径应介于 P 原子与 Cl 原子之间,B 项正确。答案:B4.下列各组元素中,按从左到右的顺序,原子序数递增、元素的最高正化合价也递增的是( )A.C、N、O、F B.Na、Be、B、CC.P、S、Cl、Ar D.Na、Mg、Al、Si解析:A 项和 C 项原子序数递增,而 A 项中 O、F 无正价,C 项中 Ar 化合价为 0 价;B 项中的原子序数不完全呈递增性变化;D 项中原子序数和最高正化合价均呈递增趋势。答案:D5.某元素 R 的最高价氧化物化学式为 RO2,且 R 的气态氢化物中氢的质量分数为 25%。此元素是( )A.C B.NC.Si D.S解析:本题涉及到元素的最高正价与负价的换算,由最高价氧化物的化学式 RO2可知它的最高正价为+4,则负价为-4,所以其气态氢化物化学式为 RH4,根据已知条件可求得 R 的相对原子质量为 12,即碳元素。答案:A6.不能说明钠的金属性比镁强的事实是( )A.钠的最高化合价为+1,镁的最高化合价为+2B.NaOH 的碱性比 Mg(OH)2的强C.钠与冷水反应剧烈,镁与冷水反应缓慢D.在熔融状态下,钠可以从 MgCl2中置换出镁解析:金属性是指元素原子失去电子的能力,与失电子数的多少无关,A 项错误;金属性强弱的证明方法常有:最高价氧化物对应水化物的碱性强弱(B 项)、单质与水(或非氧化性酸)反应的剧烈程度(C 项)、单质之间的置换反应(D 项)等,所以 B、C、D 三项均正确。答案:A7.下列事实,不能说明氯元素的非金属性比硫元素强的是( )A.氯气与 H2S 能发生置换反应B.HClO4酸性比 H2SO4强C.盐酸是强酸,氢硫酸...