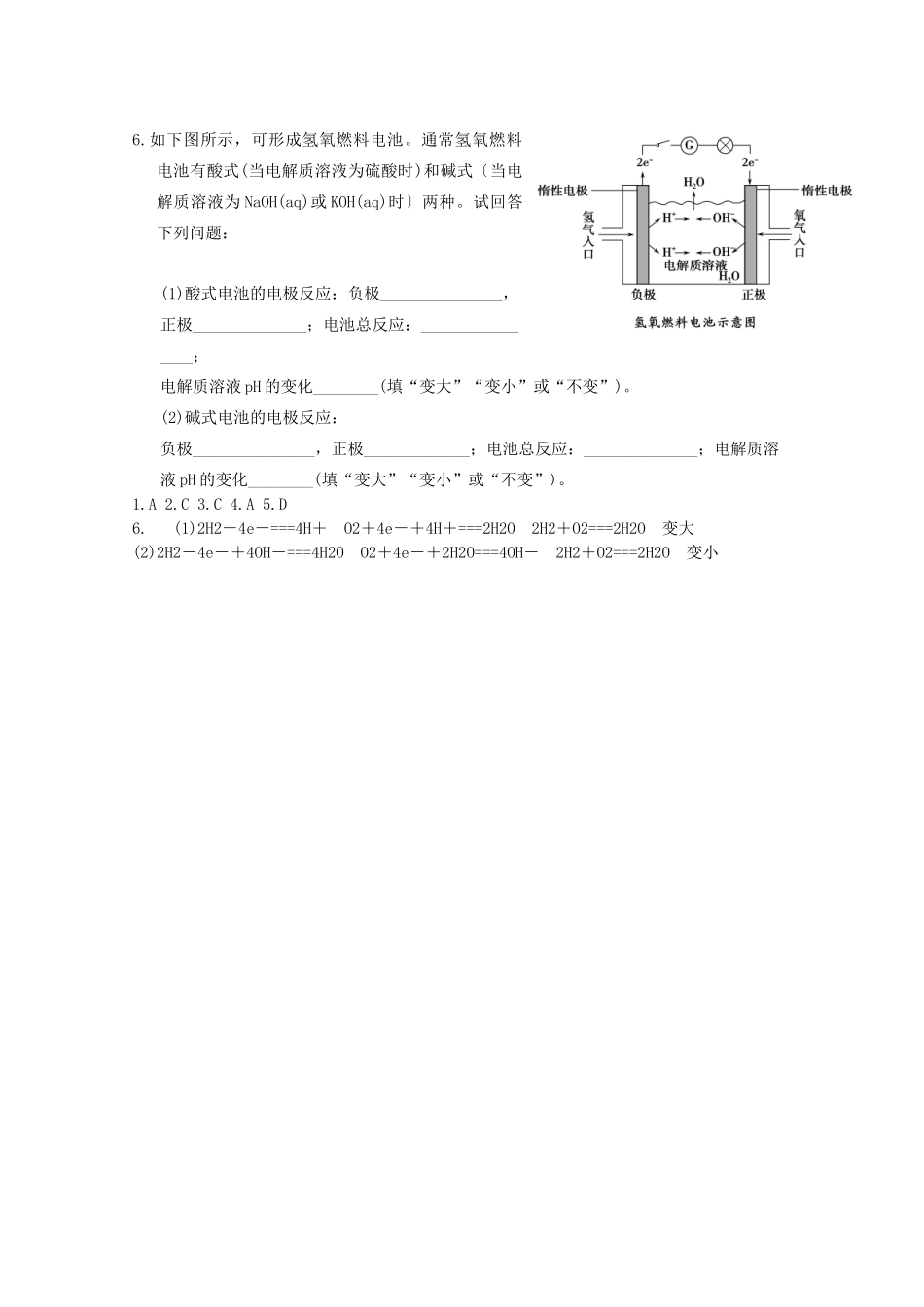
重庆市万州中学 2014-2015 学年高一化学暑假作业(7.22)1.镁燃料电池具有比能量高、使用安全方便、原材料来源丰富、成本低、燃料易于贮运等特点。研究的燃料电池可分为镁—空气燃料电池,镁—海水燃料电池,镁—过氧化氢燃料电池,镁—次氯酸盐燃料电池。如图为镁—次氯酸盐燃料电池的工作原理图,下列有关说法不正确的是A.放电过程中 OH-移向正极B.电池的总反应式为 Mg+ClO-+H2O===Mg(OH)2↓+Cl-C.镁电池中镁均为负极,发生氧化反应D.镁—过氧化氢燃料电池,酸性电解质中正极反应为:H2O2+2H++2e-===2H2O2.碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应为 Zn(s)+2MnO2(s)+H2O(l)===Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是A.电池工作时,锌失去电子B.电池正极的电极反应式为 2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq)C.电池工作时,电子由正极通过外电路流向负极D.外电路中每通过 0.2 mol 电子,锌的质量理论上减小 6.5 g3.实验室用铅蓄电池作电源电解饱和食盐水制取 Cl2,已知铅蓄电池放电时发生如下反应:负极:Pb+SO-2e-===PbSO4正极:PbO2+4H++SO+2e-===PbSO4+2H2O今欲制得 Cl2 0.050 mol, 这时电池内消耗的 H2SO4的物质的量至少是A.0.025 mol B.0.050 mol C.0.10 mol D.0.20 mol4.2012 年 6 月 16 日 18 时 37 分 24 秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的 MCFC 型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为 2H2+O2===2H2O,负极反应为 H2+CO-2e-===CO2↑+H2O,则下列推断正确的是A.电池工作时,CO 向负极移动B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极C.正极的电极反应为 4OH--2e-===O2↑+2H2OD.通氧气的电极为正极,发生氧化反应5.根据下列事实:①A+B2+A2++B;②D+2H2OD(OH)2+H2↑;③ 以 B、E 为电极与 E 的盐溶液组成原电池,电极反应为 E2++2e-E,B-2e-B2+。由此可知 A2+、B2+、D2+、E2+的氧化性强弱关系是A.D2+>A2+>B2+>E2+ B.A2+>B2+>D2+>E2+ C.D2+>E2+>A2+>B2+ D.E2+>B2+>A2+>D2+6.如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式〔当电解质溶液为 NaOH(aq)或 KOH(aq)时〕两种。试回答下...