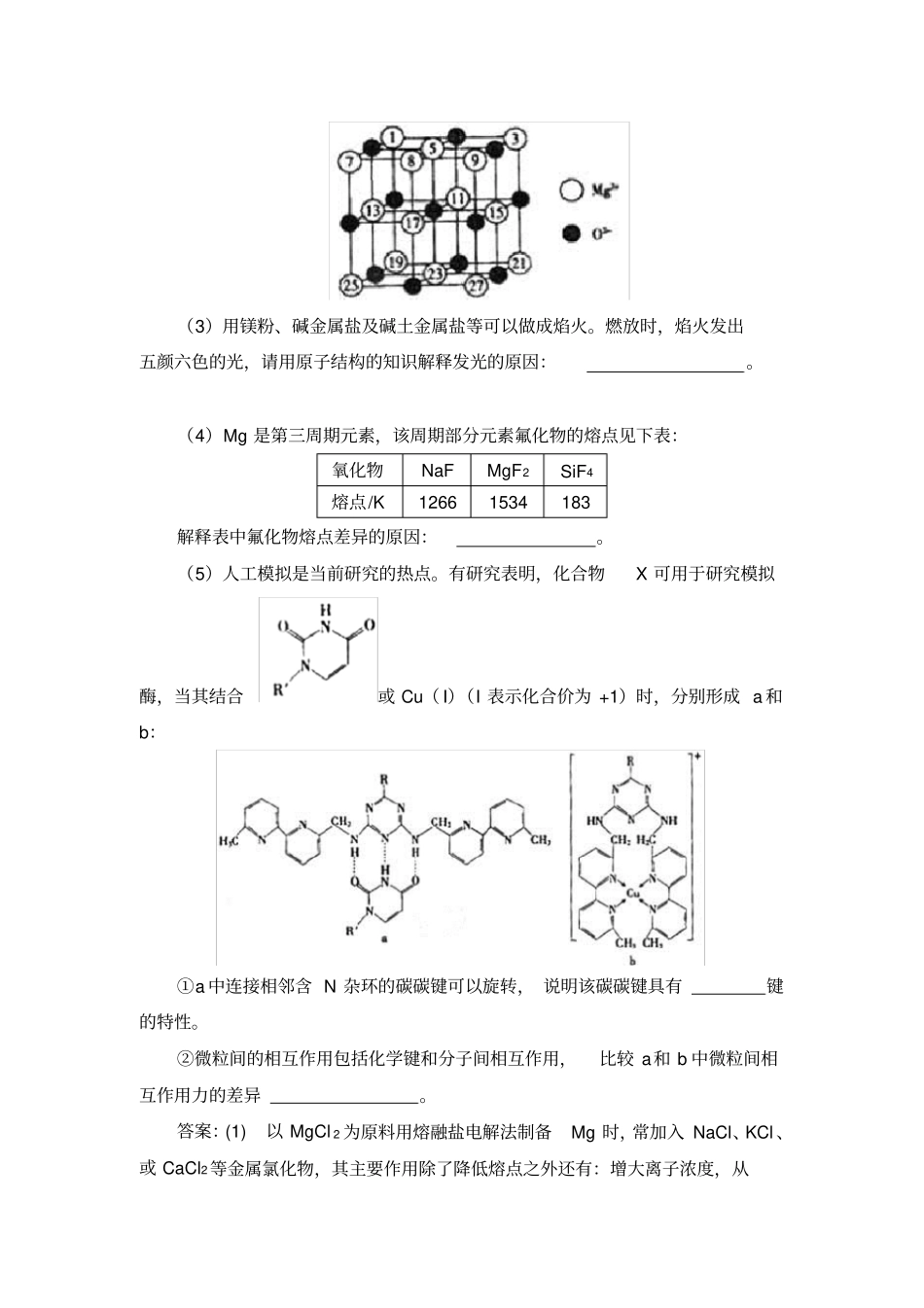
【09 高考山东】 32.C 和 Si 元素在化学中占有极其重要的地位。(1)写出 Si 的基态原子核外电子排布式。从电负性角度分析,C、 Si 和 O 元素的非金属活泼性由强至弱的顺序为。(2)SiC 的晶体结构与晶体硅的相似,其中C原子的杂化方式为,微粒间存在的作用力是。(3)氧化物 MO的电子总数与 SiC 的相等, 则 M为(填元素符号)。MO是优良的耐高温材料,其晶体结构与NaCl 晶体相似。 MO的熔点比 CaO的高,其原因是。(4)C、Si 为同一主族的元素, CO2和 SiO2化学式相似,但结构和性质有很大不同。 CO2中 C与 O原子间形成键和键, SiO2中 Si 与 O原子间不形成上述健。从原子半径大小的角度分析,为何C、O原子间能形成,而Si 、O原子间不能形成上述键。答案:(1)1s22s22p63s23p2 O>C>Si ;(2) sp3 共价键;(3)Mg Mg2+半径比 Ca2+小,MgO晶格能大;(4)Si 的原子半径较大, Si 、O原子间距离较大, p-p轨道肩并肩重叠程度较小,不能形成上述稳定的π 键【09 高考上海】 23.海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等。(1)在光照条件下,氯气和氢气反应过程如下:①2ClC1+Cl ②2Cl+HHCl+H③2H+C1HCl+Cl⋯⋯反应②中形成的化合物的电子式为;反应③中被破坏的化学键属于键(填“极性”或“非极性” )。(2)在短周期主族元素中,氯元素及与其相邻元素的原子半径从大到小的顺序是(用元素符号表示 )。与氯元素同周期且金属性最强的元素位于周期表的第周期族。(3)卤素单质及化合物在许多性质上都存在着递变规律。下列有关说法正确的是。a.卤化银的颜色按AgCl、AgBr 、AgI 的顺序依次加深b.卤化氢的键长按H— F、H— C1、H— Br、H— I 的顺序依次减小c.卤化氢的还原性按HF、HCl、HBr 、HI 的顺序依次减弱d.卤素单质与氢气化合按2F 、2Cl 、2Br 、2I 的顺序由难变易(4)卤素单质的键能大小如右图。由图推断:①非金属性强的卤素,其单质分子的化学键断裂 (填“容易”或“不容易”或“不一定容易”)。②卤素单质键能大小与键长的关系为:答案:(1)非极性;(2)S Cl F 三IA ;(3)a;(4)①不一定容易②除 F2 外,键长增长,键能减小【08 高考山东】32.[化学—物质结构与性质] 氮是地球上极为丰富的元素。(1)Li 3N 晶体中氮以 N3-的存在,基态 N3-的电子排布式为。(2)N≡N 的键能为 942 kJ· mol-1,N-N 单键的键能为 247 kJ· mol-1...