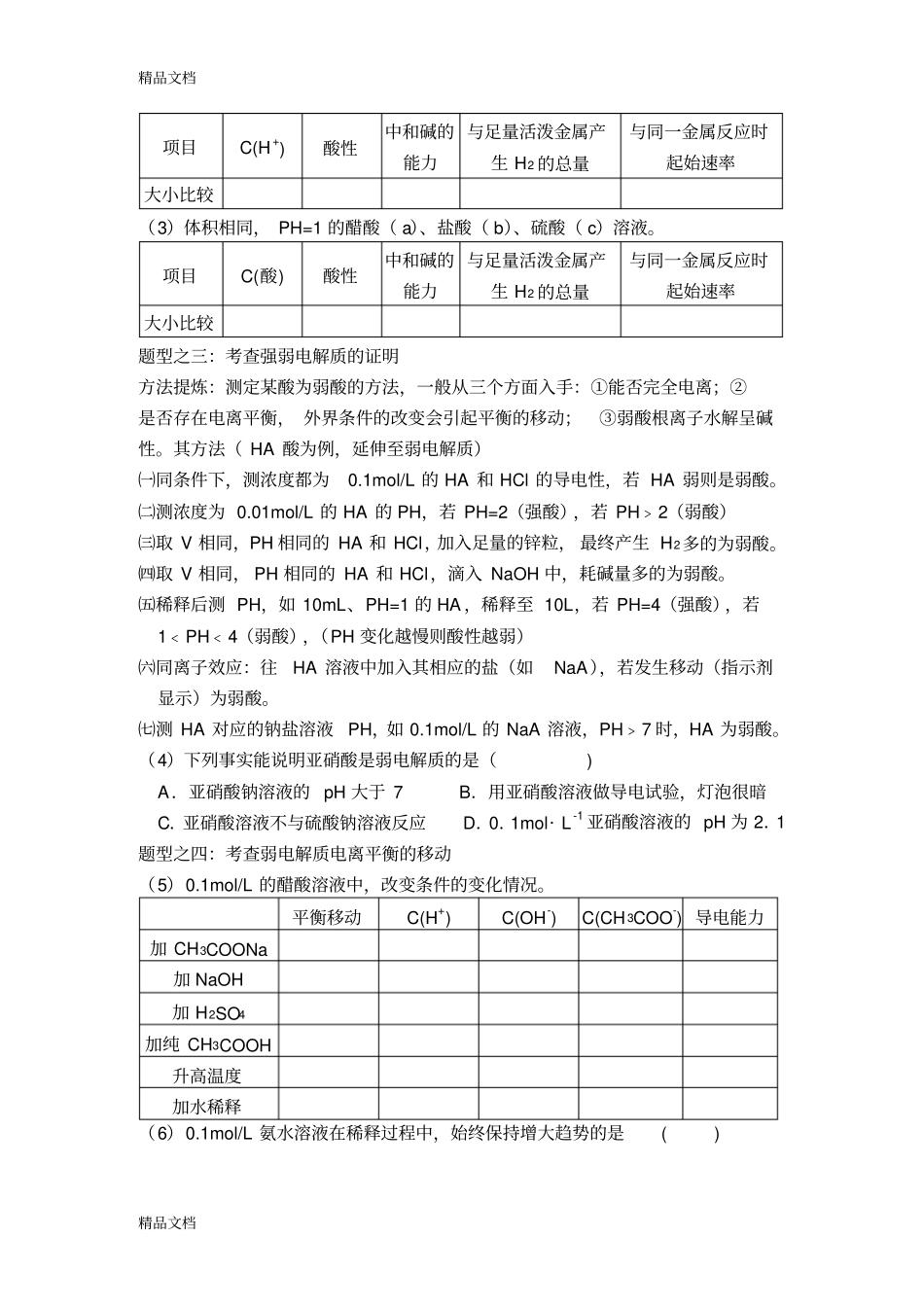
精品文档精品文档高三水溶液中的离子平衡专题复习第一节电离平衡一: 强、弱电解质概念辨析:⑴“盐类水解”中的“强、弱”就来自于电解质中强碱或弱碱中的阳离子和强酸或弱酸中的阴离子。⑵ 电解质和非电解质都是化合物, 单质和混合物即不是电解质也不是非电解质。⑶ 判断电解质看该化合物能否自身电离,如SO3、SO2、NH 3 等是非电解质。⑷ 判断电解质的强弱看它能否完全电离(在水溶液或熔化时) ,与其溶解性的大小、导电性强弱无关。⑸ 溶液的导电性与自由移动的离子浓度及离子所带的电荷数目有关,而与电解质的强弱无必然的关系。⑹ 有的电解质只能在水溶液中导电,如酸;有的电解质在水溶液和熔化状态下都能导电,如碱、盐。此法可区分共价键和离子键。二:电解质的电离及电离平衡注:多元弱酸分步电离,每次只电离出一个H+,以为主 例:⑶ 影响弱电解质电离平衡的因素:见表。三:本节题型题型之一:考查电解质的判断(1) 下列物质的水溶液能导电,但属于非电解质的是()A.COOHCH 3B.2ClC.34HCONHD.2SO题型之二:考查强弱电解质的比较(2)体积相同,浓度均为0.1mol/L 的醋酸( a)、盐酸( b)、硫酸( c)溶液。强酸强碱大多数盐弱酸弱碱水和少数盐电解质强电解质化合物弱电解质某些金属氧化物非电解质单质纯净物混合物物质精品文档精品文档项目C(H +) 酸性中和碱的能力与足量活泼金属产生 H2 的总量与同一金属反应时起始速率大小比较(3)体积相同, PH=1 的醋酸( a)、盐酸( b)、硫酸( c)溶液。项目C(酸) 酸性中和碱的能力与足量活泼金属产生 H2 的总量与同一金属反应时起始速率大小比较题型之三:考查强弱电解质的证明方法提炼:测定某酸为弱酸的方法,一般从三个方面入手:①能否完全电离;②是否存在电离平衡, 外界条件的改变会引起平衡的移动;③弱酸根离子水解呈碱性。其方法( HA 酸为例,延伸至弱电解质)㈠同条件下,测浓度都为0.1mol/L 的 HA 和 HCl 的导电性,若 HA 弱则是弱酸。㈡测浓度为 0.01mol/L 的 HA 的 PH,若 PH=2(强酸),若 PH﹥2(弱酸)㈢取 V 相同,PH 相同的 HA 和 HCl,加入足量的锌粒, 最终产生 H2多的为弱酸。㈣取 V 相同, PH 相同的 HA 和 HCl,滴入 NaOH 中,耗碱量多的为弱酸。㈤稀释后测 PH,如 10mL、PH=1 的 HA ,稀释至 10L,若 PH=4(强酸),若1﹤PH﹤4(弱酸),(PH 变化越慢则酸性越弱)㈥同离子效...