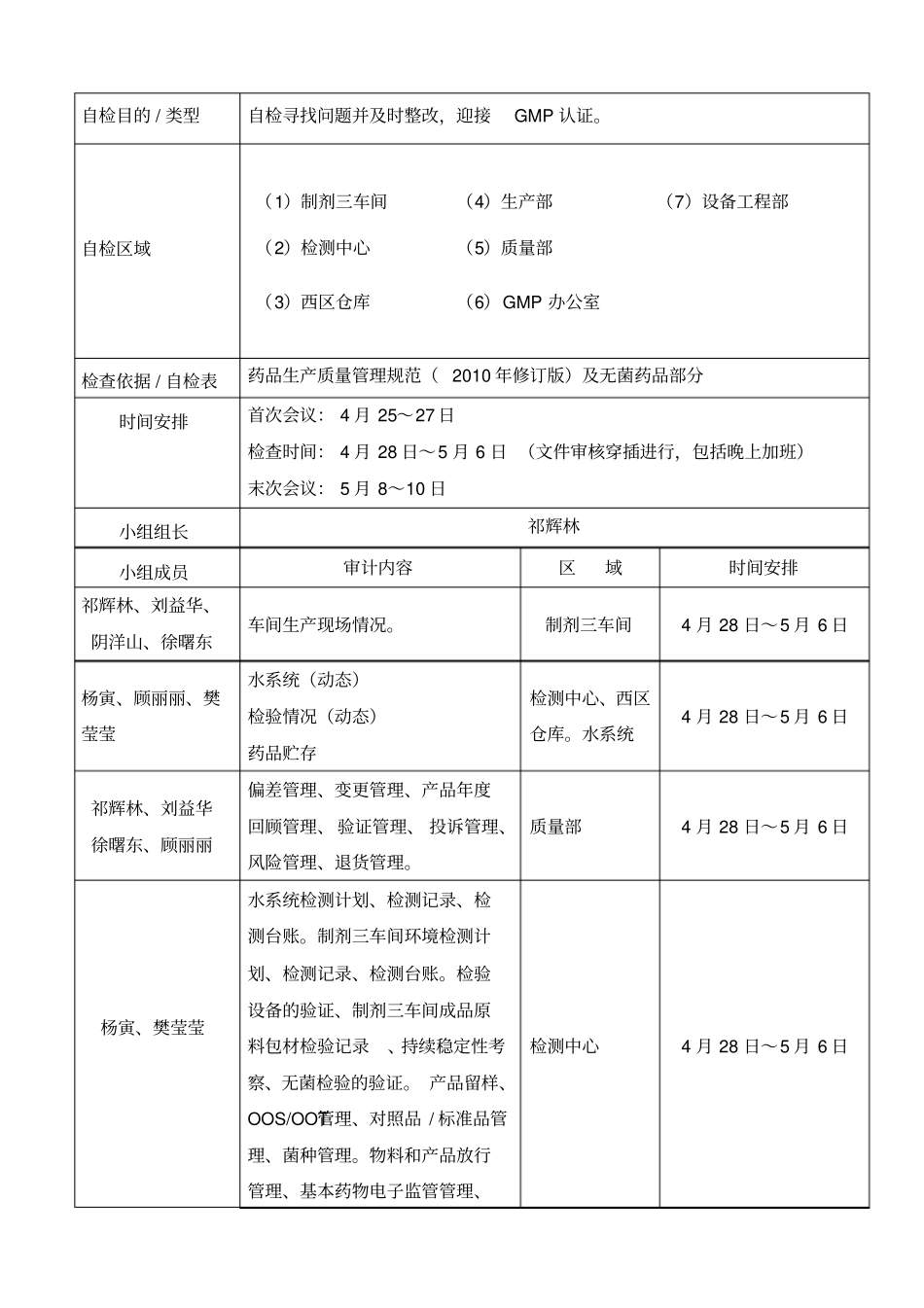
自检目的 / 类型自检寻找问题并及时整改,迎接GMP 认证。自检区域(1)制剂三车间(4)生产部(7)设备工程部(2)检测中心(5)质量部(3)西区仓库(6)GMP 办公室检查依据 / 自检表药品生产质量管理规范( 2010 年修订版)及无菌药品部分时间安排首次会议: 4 月 25~27 日检查时间: 4 月 28 日~5 月 6 日 (文件审核穿插进行,包括晚上加班)末次会议: 5 月 8~10 日小组组长祁辉林小组成员审计内容区域时间安排祁辉林、刘益华、阴洋山、徐曙东车间生产现场情况。制剂三车间4 月 28 日~5 月 6 日杨寅、顾丽丽、樊莹莹水系统(动态)检验情况(动态)药品贮存检测中心、西区仓库。水系统4 月 28 日~5 月 6 日祁辉林、刘益华徐曙东、顾丽丽偏差管理、变更管理、产品年度回顾管理、 验证管理、 投诉管理、风险管理、退货管理。质量部4 月 28 日~5 月 6 日杨寅、樊莹莹水系统检测计划、检测记录、检测台账。制剂三车间环境检测计划、检测记录、检测台账。检验设备的验证、制剂三车间成品原料包材检验记录、持续稳定性考察、无菌检验的验证。 产品留样、OOS/OOT管理、对照品 / 标准品管理、菌种管理。物料和产品放行管理、基本药物电子监管管理、检测中心4 月 28 日~5 月 6 日药品不良反应管理。不合格品管理、印刷包材管理。召回管理供应商管理、生产计划、期生产指令阴洋山、顾丽丽、设备台账、设备档案、计量器具台账及校准记录、设备URS台账及 URS报告、设备维修记录、维护保养记录、年度评估报告、人员培训、自检档案、文件管理、健康管理。工艺规程、生产记录设 备 规 程 。GMP 办4 月 28 日~5 月 6 日编制:审核:批准:表 A-1 Rev.0 (15/03/2012)制剂三车间现场检查自检内容1、 人员进出厂房检查人员进出控制措施及记录;评估有效性。检查三防措施的位置的合理性;检查三防措施检查记录、设施清洁记录;评估人员进出流程是否合理;检查手机、首饰、手表等私人物品管理;检查更衣设施的卫生以及一更的厂房的维护情况;检查评估厂房物流与人流设置是否合理。检查门禁电子的记录2、 人员进入洁净区厂房检查人员进出控制措施及记录;评估有效性;检查人员进入洁净区数量的控制方法,评估有效性;检查洁净区工作服的材质、式样、颜色是否合理;检查洁净区洗手水池、地漏是否存在污染、评估水池是否易清洁;检查更衣室的压差表的设置,评估压差梯度是否合理;检...