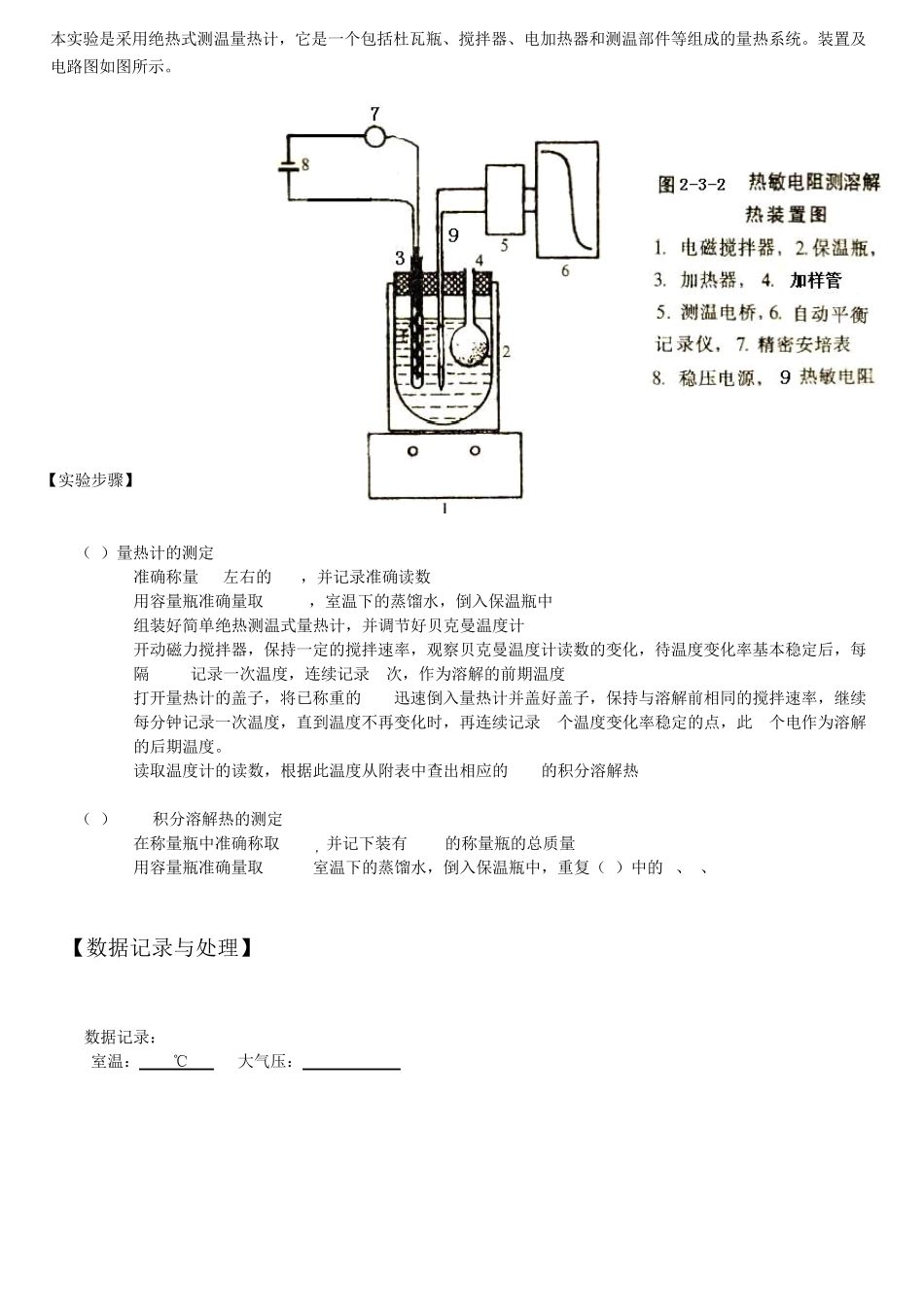
华 南 师 范 大 学 实 验 报 告 学生姓名 吴俊烽 学 号 2 0 1 1 2 4 0 1 0 1 9 专 业 化学教育 年级班级 1 1 化四 课程名称 物理化学实验 实验项目 溶解热的测定 指导老师 李国良 时 间 2 0 1 3 年1 1 月1 9 日 【实验目的】 1. 设计简单量热装置测定某物质在水中的积分溶解焓 2. 复习和掌握常用的量热技术与温度测定与校正方法 3. 由作图法求出该物质在水中的摩尔稀释焓、微分溶解焓、微分稀释焓。 【实验原理】 物质溶于溶剂中,一般伴随有热效应的发生。盐类的溶解通常包含着几个同时进行的过程:晶格的破坏、离子或分子的溶剂化、分子电离(对电解质而言)等。热效应的大小和符号决定于溶剂及溶质的性质和它们的相对量。 在热化学中,关于溶解过程的热效应,需要了解以下几个基本概念。 溶解热 在恒温恒压下,溶质B溶于溶剂A(或溶于某浓度溶液)中产生的热效应,用表示。 摩尔积分溶解热 在恒温恒压下,1 mol溶质溶解于一定量的溶剂中形成一定浓度的溶液,整个过程产生的热效应。用表示。 (1) 式中,为溶解于溶剂A中的溶质B的物质的量。 摩尔微分溶解热 在恒温恒压下,1mol溶质溶于某一确定浓度的无限量的溶液中产生的热效应,以表示,简写为。 稀释热 在恒温恒压下,一定量的溶剂A加到某浓度的溶液中使之稀释,所产生的热效应。 摩尔积分稀释热 在恒温恒压下,在含有1mol溶质的溶液中加入一定量的溶剂,使之稀释成另一浓度的溶液,这个过程产生的热效应,以表示。 (2) 式中,、为两种浓度的摩尔积分溶解热。 摩尔微分稀释热 在恒温恒压下,1mol溶剂加入到某一浓度无限量的溶液中所发生的热效应,以表示,简写为。 在恒温恒压下,对于指定的溶剂A和溶质B,溶解热的大小取决于A和B的物质的量即 (3)由(3)式可推导得: (4) 或 (5) 令,(5)改写为: (6) 本实验采用标准物质进行量热计能当量的标定。利用1molKCl溶于200mol水中的积分溶解热数据进行量热计的标定。 可设计途径如下: ↓ 在上述途径中,1H为KCl(s)、OH2(l)以及量热计温度改变过程的焓变,2H则为在T2温度下,物质的量为n1 mol的KCl(s)溶于n2 mol OH2(l)中,形成终态溶液的焓变。 因为1221HH0HH H 所以 ]),(),([KHnH]),(),([11221msol122,2,11TMHmlOHCmsKClCmTKlOHCnsKClCnHmsolppmpmp 则KNO3的积分溶解热 TKlOH...