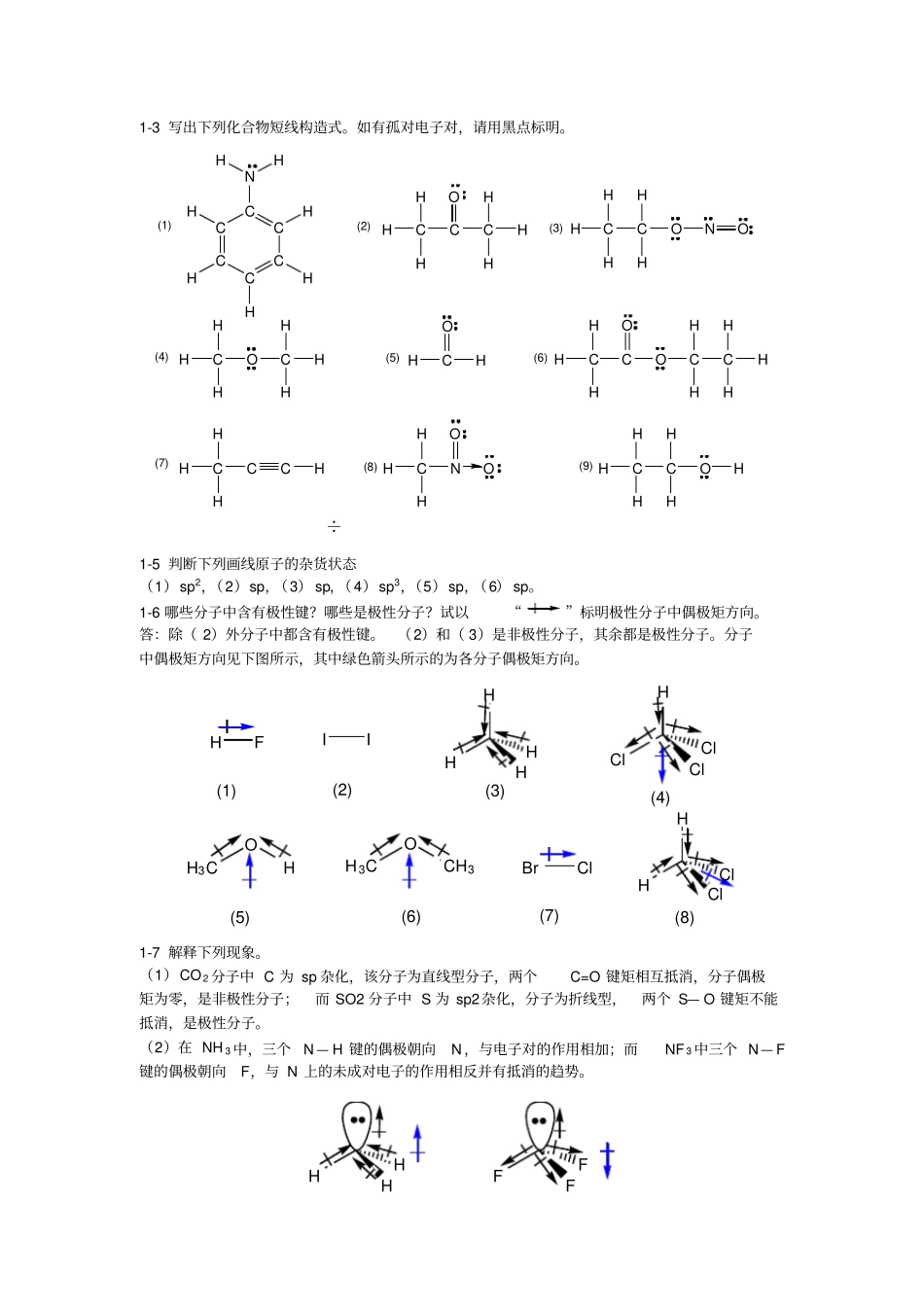
1-3 写出下列化合物短线构造式。如有孤对电子对,请用黑点标明。÷CCCCCCNHHHHHHHCCHHHCOHHHHCHHCHHONOHCHHOCHHHHCHOHCHHCOOCCHHHHHHCHHCCHHCHHNOOHCHHCHHOH(1)(2)(3)(4)(5)(6)(7)(8)(9)1-5 判断下列画线原子的杂货状态(1)sp2,(2)sp,(3) sp,(4)sp3,(5)sp,(6) sp。1-6 哪些分子中含有极性键?哪些是极性分子?试以“”标明极性分子中偶极矩方向。答:除( 2)外分子中都含有极性键。(2)和( 3)是非极性分子,其余都是极性分子。分子中偶极矩方向见下图所示,其中绿色箭头所示的为各分子偶极矩方向。HFBrClHClClClHHClClH3COCH3H3COHIIHHHH(1)(2)(3)(4)(5)(6)(7)(8)1-7 解释下列现象。(1)CO 2 分子中 C 为 sp 杂化,该分子为直线型分子,两个C=O 键矩相互抵消,分子偶极矩为零,是非极性分子;而 SO2 分子中 S 为 sp2杂化,分子为折线型,两个 S— O 键矩不能抵消,是极性分子。(2)在 NH 3 中,三个N— H 键的偶极朝向N,与电子对的作用相加;而NF 3 中三个 N— F键的偶极朝向F,与 N 上的未成对电子的作用相反并有抵消的趋势。HHHFFF(3)Cl 和 F 为一同主族元素,原子共价半径是Cl 比 F 大,而电负性是F 比 Cl 大。键的偶极矩等于μ=qd,q 为正电荷中心或负电荷中心上的电荷量,d 为正负电荷中心的距离。HCl键长虽比 HF 的长,但 F-中心上的电荷量大大于Cl -上的电荷量, 总的结果导致HF 的偶极矩大于 HCl 。所以键长是H— Cl 较长,偶极矩是H— F 较大。1-8 将下列各组化合物中指定键的键长由长到短排列并说明理由。答:(1)从乙烷,乙烯到乙炔,碳原子杂化态由sp3 到 sp2 至 sp,s 成份提高,拉电子能力增强,虽同属于碳氢键但键长缩短。(2)键长顺序为C— I>C— Br>C— Cl>C— F。因为卤素原子核外电子层数为I>Br> Cl>F,即其范德华半径为I>Br>Cl >F,则其原子共价半径I>Br >Cl>F。(3)碳碳键键长为乙烷>乙烯>乙炔。因为碳原子杂化态由sp3 到 sp2 至 sp,其共价键分别为单键、双键和叁键,碳碳原子间的作用力是乙烷<乙烯<乙炔,作用力越强,则两原子被拉得越紧,键长越短。1-9 将下列各组化合物按酸性由强到弱排列。(1)D>A>C>B;( 2)A >B>D>C 1-10 下列物种哪些是: (1)亲核试剂, (2)亲电试剂, (3)既是亲核试剂又是亲电试剂?答;(1)亲核试剂: Cl -,H 2O,CH 3OH ,CH 2=CH 2,HC...