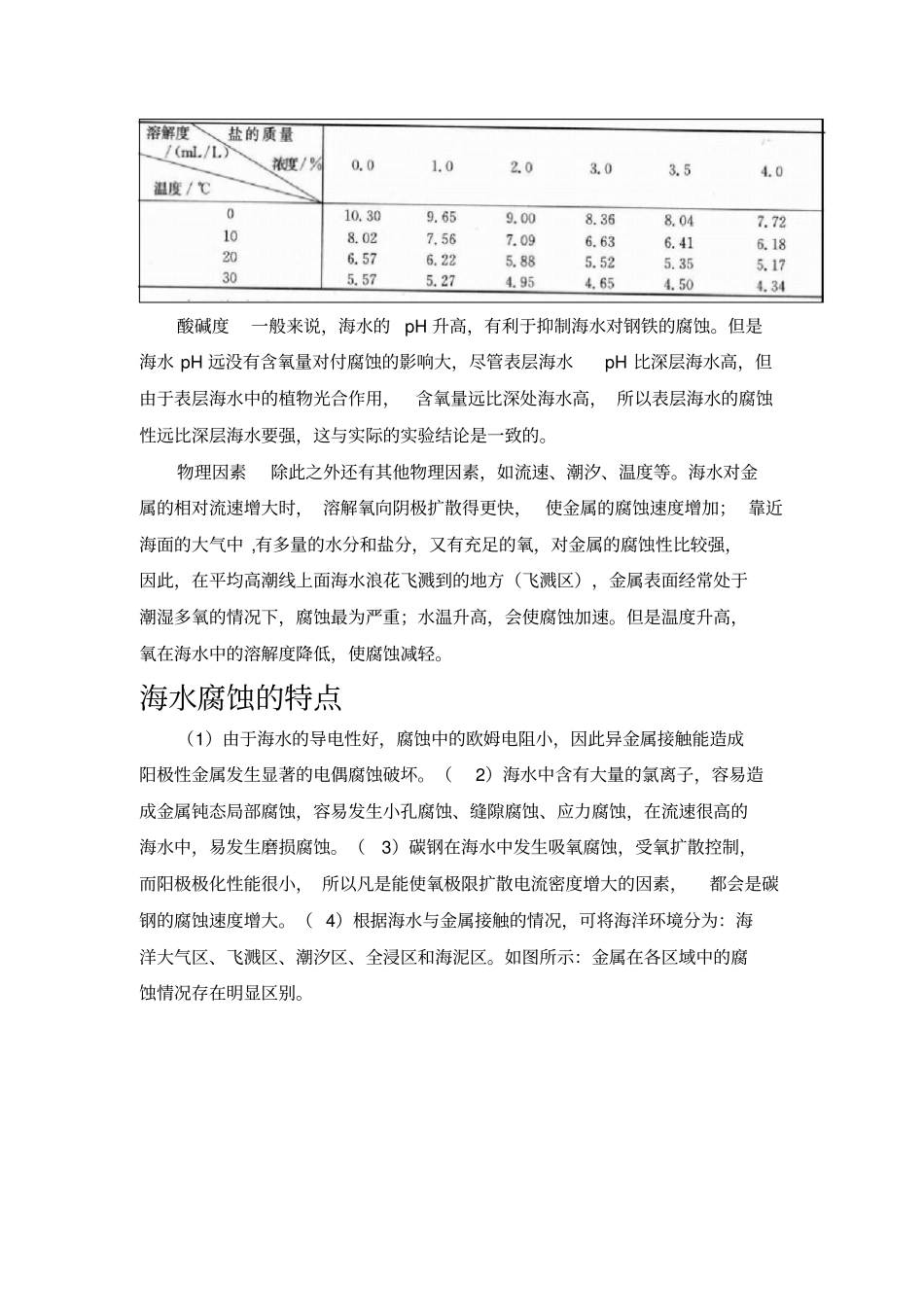
海水腐蚀情况海水腐蚀的原因浸入海水中的金属,表面会出现稳定的电极电势。由于金属有晶界存在,物理性质不均一; 实际的金属材料总含有些杂质,化学性质也不均一; 加上海水中溶解氧的浓度和海水的温度等,可能分布不均匀,因此金属表面上各部位的电势不同 ,形成了局部的腐蚀电池或微电池。其中电势较高的部位为阴极,较低的为阳极。电势较高的金属,例如铁,腐蚀时阳极进行铁的氧化;电势较低的金属,例如镁,被海水腐蚀时,镁作为阳极而被溶解,阴极处释放出氢。当电势不同的两种金属在海水中接触时,也形成腐蚀电池,发生接触腐蚀。例如锌和铁在海水中接触时 ,因锌的电势较低 ,腐蚀加快;铁的电势较高,腐蚀变慢,甚至停止。海洋环境对腐蚀的影响盐度海水含盐量较高, 水中的含盐量直接影响水的电导率和含氧量,随着水中含盐量的增加, 水的电导率增加但含氧量却降低。 海水中的盐度并不和NaCl的行为相一致, 这是因为其中所含的钙离子和镁离子,能够在金属表面析出碳酸钙和氢氧化镁的沉淀, 对金属有一定的保护作用。 河口区海水的盐度低, 钙和镁的含量较小,金属的腐蚀性增加。海水中的氯离子能破坏金属表面的氧化膜,并能与金属离子形成络合物,后者在水解时产生氢离子,使海水的酸度增大,使金属的局部腐蚀加强。电导率海水中不仅含盐量高, 而且其中的盐类几乎全部处于电离状态,这使得海水成为一种导电性良好的电解质。这就决定了海水腐蚀过程中, 不仅微观电池腐蚀的活性大,同时宏观电池的活性也大。研究表明:随着电导率的增大,微观电池腐蚀和宏观电池腐蚀都将加速。溶解氧海水溶解氧的含量越多, 金属在海水中的电极电位越高,金属的腐蚀速度越快。 但对于铝和不锈钢一类金属,当其被氧化时, 表面形成一薄层氧化膜,保护金属不再被腐蚀,即保持了钝态。此外,在没有溶解氧的海水中,铜和铁几乎不受腐蚀。(常压下氧在海水中的溶解度如下)(表一)酸碱度一般来说,海水的pH 升高,有利于抑制海水对钢铁的腐蚀。但是海水 pH 远没有含氧量对付腐蚀的影响大,尽管表层海水pH 比深层海水高,但由于表层海水中的植物光合作用,含氧量远比深处海水高, 所以表层海水的腐蚀性远比深层海水要强,这与实际的实验结论是一致的。物理因素除此之外还有其他物理因素,如流速、潮汐、温度等。海水对金属的相对流速增大时, 溶解氧向阴极扩散得更快, 使金属的腐蚀速度增加; 靠近海面的大气中 ,有多量的水分和盐分,又有充足...