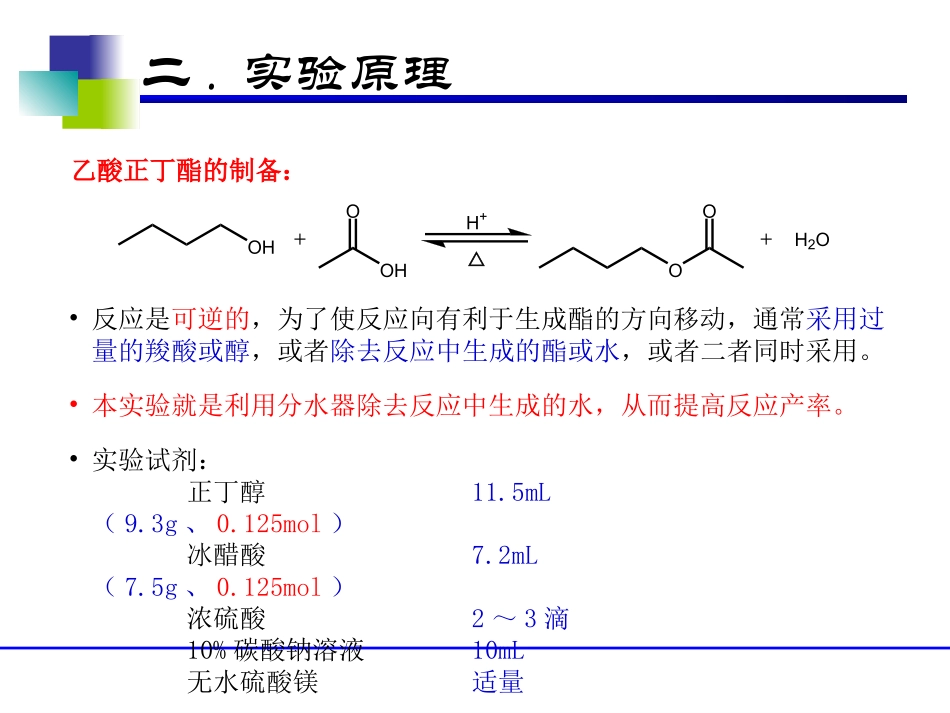
《有机化学实验》乙酸正丁酯的制备一.实验目的•学习酯化反应的基本原理和制备方法;•掌握利用分水器进行共沸蒸馏的脱水方法,复习萃取、洗涤、蒸馏等纯化技术。二.实验原理OHO++H2OOHOOH+△乙酸正丁酯的制备:•实验试剂:正丁醇11.5mL(9.3g、0.125mol)冰醋酸7.2mL(7.5g、0.125mol)浓硫酸2~3滴10%碳酸钠溶液10mL无水硫酸镁适量•反应是可逆的,为了使反应向有利于生成酯的方向移动,通常采用过量的羧酸或醇,或者除去反应中生成的酯或水,或者二者同时采用。•本实验就是利用分水器除去反应中生成的水,从而提高反应产率。二.实验原理•实验装置包括三个部分:反应瓶、分水器、冷凝管。分水器的工作原理:•反应瓶中液体受热反应产生的共沸多组分蒸汽上升,经过分水器到达球形冷凝管,蒸汽被冷却后转换成液体进入分水器中,因液体中各组分的极性、密度不同,分水器中的液体形成分层。分水器中液体的液面超过支管口,上层的液体流回反应瓶。•本实验中共沸多组分蒸汽中乙酸正丁酯、正丁醇的密度均低于水,故上层液体主要为乙酸正丁酯、正丁醇。二.实验原理•干燥是用来除去固体、气体或液体中含有少量水分和少量有机溶剂杂质的方法之一。干燥剂的使用:•干燥方法大致可分为物理法和化学法。吸附、分馏、利用共沸蒸馏将水分带走等利用干燥剂与水发生反应来除去水•干燥剂可分为两类:一类是能与水可逆地结合成水合物,因此可再生后反复使用,如无水氯化钙、无水硫酸钙、无水硫酸镁等;另一类干燥剂则与水反应生成新的化合物,如五氧化二磷、氧化钙、金属钠等,此类干燥剂不能反复使用。•液体有机化含物的干燥:在液体有机化合物中加入一定量合适的干燥剂,在振荡下使水被干燥剂吸收,然后静置一段时间,最后将其与干燥剂分离。用干燥剂干燥液体有机化合物,只能除去少量的水,若试样含有大量水,必须事先设法除去。干燥用时取决于干燥剂与被作用杂质间的相互作用的速率,一般要求静置30min以上。可采用过滤或倾倒的方法分离干燥剂二.实验原理•干燥剂的选择:所用的干燥剂不能与该物质发生化学反应或催化作用,不溶解于该液体中。同时还要考虑干燥剂的吸水容量和干燥效能。干燥剂的使用:(续)•干燥剂的用量:一般干燥剂的用量为每10mL液体约需0.5~1g;具体实验操作中,一般靠观察干燥剂的形态来判别干燥剂的用量是否合适。•干燥实验操作:将该液体置于锥形瓶中,用勺子取适量的干燥剂直接放入液体中,塞好塞子,振摇片刻。如干燥剂附着瓶壁,相互粘结,则干燥剂量不够;如干燥剂散落在瓶底,且干燥剂棱角清楚可辨,则表明用量已合适。加入足够的干燥剂后,液体静置一段时间,最后通过滤纸(或棉花)和漏斗过滤即可。萃取操作萃取(洗涤)是利用物质在两种互不相溶(或微溶)的溶剂中溶解度或分配系数的不同来达到分离、提取或纯化目的的一种操作。分配定律:在一定温度、一定压力下一种物质在两种互不相溶的溶剂A、B中的分配浓度之比是一个常数(分配系数)。KccBA常数假设:V0为原溶液的体积(mL);w1、w2、……、wn分别为萃取一次、二次、……、n次后溶质的剩余量(g);V为每次萃取溶剂的体积(mL)。KVwwVw1001VKVKVww0001第一次萃取:第二次萃取:KVwwVw210220000012VKVKVwVKVKVwwnnVKVKVww000第n次萃取:100VKVKVnnnVnKVnKVwnVKVKVww0000001n2n3nnxwyn同样体积的溶剂,分多次萃取比一次萃取的效率高。但并非萃取次数越多越好,从诸因素综合考虑一般以萃取3次为宜。分液漏斗的使用(1)规格选择:(2)检漏:(3)涂凡士林:(4)振摇(放气):(5)静置分层:比溶液体积(被萃取液+萃取溶剂)大一倍以上放置铁圈上静置片刻一般即可分层;但也可能因为乳化而分层缓慢;消除乳化的常见办法:长时间静置;加入适量的NaCl溶液(限其中一相为水相)中和由于静电而产生的乳化;另外还有其它作用:①盐析,降低有机物在水相中的溶解度;②增加水相的密度,而可能使两相密度差增大使分层更快...