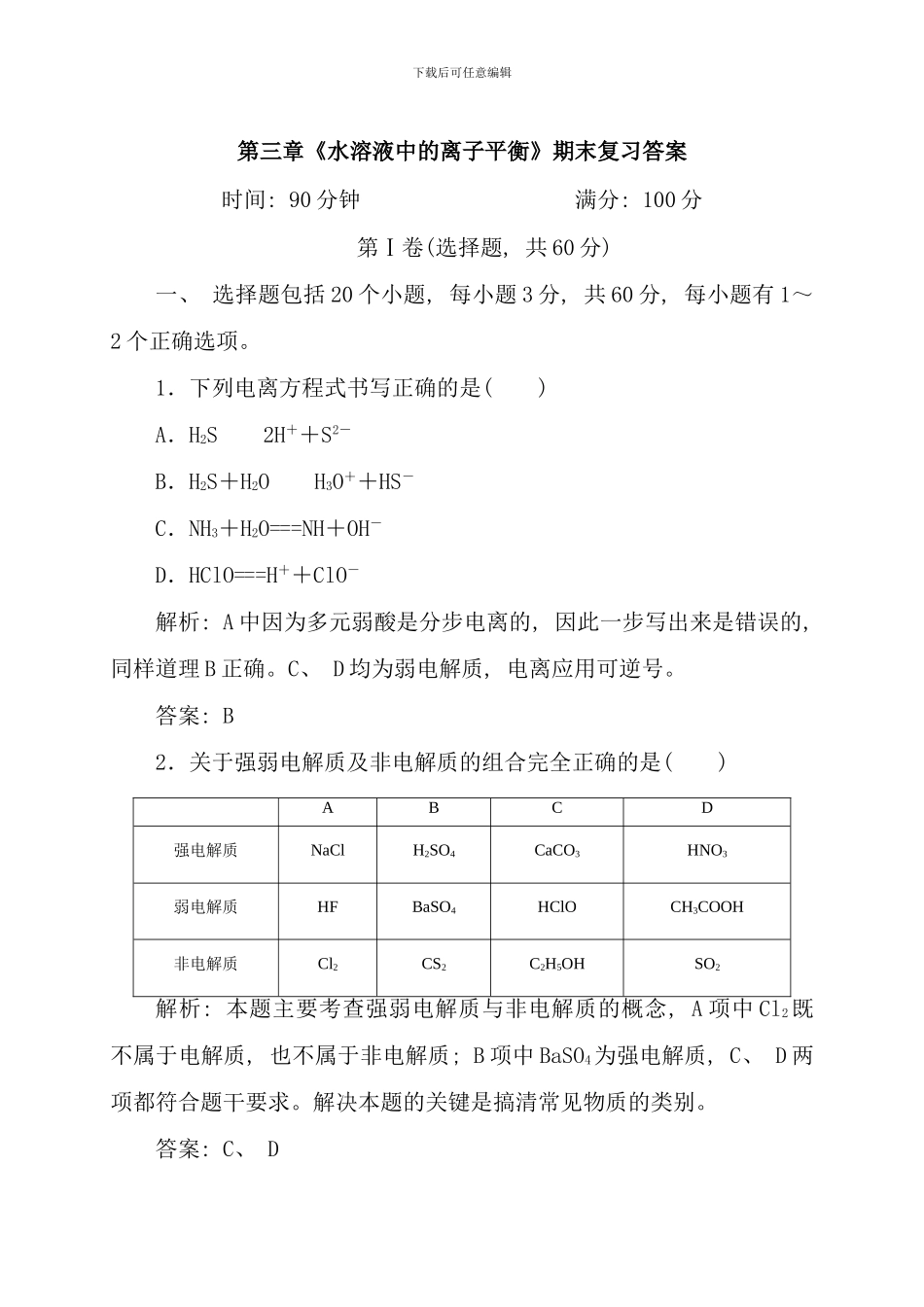
下载后可任意编辑第三章《水溶液中的离子平衡》期末复习答案时间: 90 分钟 满分: 100 分第Ⅰ卷(选择题, 共 60 分)一、 选择题包括 20 个小题, 每小题 3 分, 共 60 分, 每小题有 1~2 个正确选项。1.下列电离方程式书写正确的是( )A.H2S2H++S2-B.H2S+H2OH3O++HS-C.NH3+H2O===NH+OH-D.HClO===H++ClO-解析: A 中因为多元弱酸是分步电离的, 因此一步写出来是错误的, 同样道理 B 正确。C、 D 均为弱电解质, 电离应用可逆号。答案: B2.关于强弱电解质及非电解质的组合完全正确的是( )ABCD强电解质NaClH2SO4CaCO3HNO3弱电解质HFBaSO4HClOCH3COOH非电解质Cl2CS2C2H5OHSO2解析: 本题主要考查强弱电解质与非电解质的概念, A 项中 Cl2既不属于电解质, 也不属于非电解质; B 项中 BaSO4为强电解质, C、 D 两项都符合题干要求。解决本题的关键是搞清常见物质的类别。答案: C、 D下载后可任意编辑3.等体积的下列各溶液中, 阴离子的总浓度最大的是( )A.0.2mol·L-1Na2CO3溶液B.0.1mol·L-1Ba(OH)2溶液C.0.2mol·L-1CH3COOH 溶液D.0.2mol·L-1的氨水解析: 各选项阴离子浓度 : B 中等于 0.2mol·L - 1, C 中小于0.2mol·L-1, D 中也小于 0.2mol·L-1, 而 A 由于 CO+H2OHCO+OH-, 而使阴离子浓度大于 0.2mol·L-1。答案: A4.在标准状况下, 向 100mL 氢硫酸溶液中通入二氧化硫气体, 溶液 pH 的变化如下图所示, 则原氢硫酸溶液的物质的量浓度为( )A.0.5mol/L B.0.005mol/LC.1mol/L D.0.1mol/L答案: D5.下列关于盐酸与醋酸两种稀溶液的说法正确的是( )A.相同浓度的两溶液中 c(H+)相同B.100mL 0.1mol/L 的两溶液能中和等物质的量的氢氧化钠下载后可任意编辑C.pH=3 的两溶液稀释 100 倍, pH 都为 5D.两溶液中分别加入少量对应的钠盐, c(H+)均明显减小答案: B6.99℃时, 向 pH=6 的蒸馏水中加入 NaHSO4晶体, 保持温度不变, 测得溶液的 pH=2, 下列叙述中不正确的是( )A.此时水的离子积 KW=1×10-14B.水电离出的 c(H+)=1×10-10mol·L-1C.水的电离程度随温度升高而增大D.c(Na+)=c(SO)解析: 本题考查水的电离及水的离子积, 蒸馏水中 pH=6, c(H+)=10-6mol/L, 因此 KW=1×10-12, A 项不正确; NaHSO4溶液中 c(H+)=10-2mol/L, c(OH-)===1×10-10mol/L, B 项正确; 水...