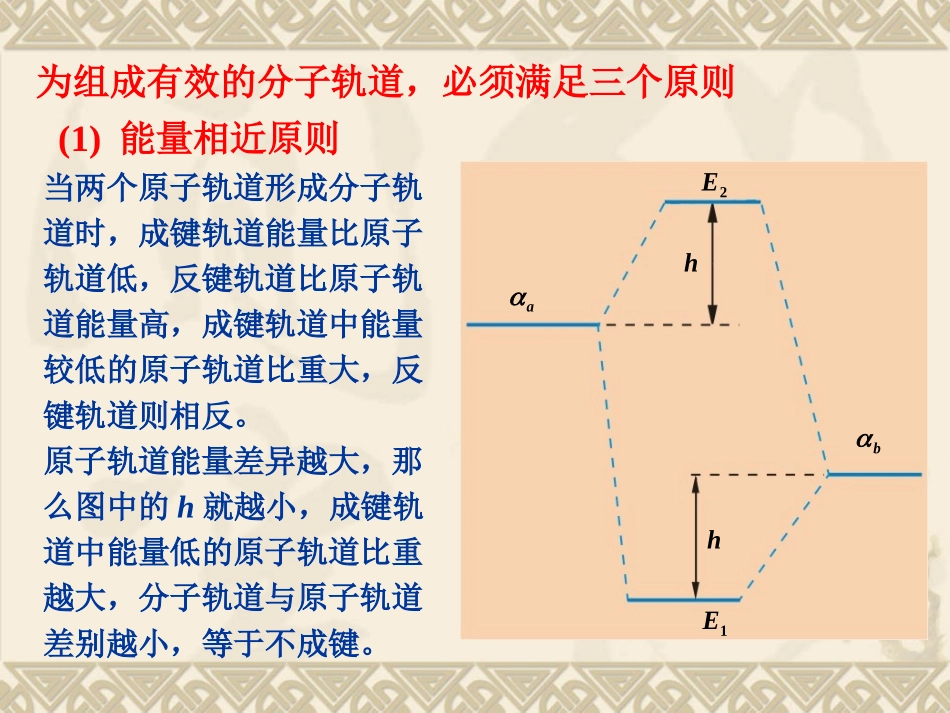
3.33.3分子轨道理论和分子轨道理论和双原子分子结构双原子分子结构3.3.1简单分子轨道理论1分子轨道的概念与原子类似,对分子仍采用单电子近似:电子在整个分子形成的有效势中运动,分子的空间波函数是每个电子的空间波函数的乘积:NiiiiiNNNNNNNzyxzyxzyxzyxzyxzyx122221111111),,(),,(),,(),,(),,,,,,(单电子波函数就是分子轨道2分子轨道的形成(1)在单电子近似下的分子轨道(即单电子空间波函数),可以由原子轨道的线性组合构成。(2)分子轨道的个数等于构成它的原子轨道的个数,轨道个数不变,但轨道能级改变,分子轨道能级低于原子轨道能级的称为成键轨道,反之为反键轨道。例:对于甲烷分子来说,其分子轨道可以用四个氢原子的1s轨道以及碳原子的1s,2s,2px,2py和2pz线性叠加构成。(3)分子轨道相互正交——线性组合不是随意的为组成有效的分子轨道,必须满足三个原则(1)能量相近原则2E1Eabhh当两个原子轨道形成分子轨道时,成键轨道能量比原子轨道低,反键轨道比原子轨道能量高,成键轨道中能量较低的原子轨道比重大,反键轨道则相反。原子轨道能量差异越大,那么图中的h就越小,成键轨道中能量低的原子轨道比重越大,分子轨道与原子轨道差别越小,等于不成键。(2)轨道最大重叠原则:成键的方向性。(3)对称性匹配原则:最重要的一条原则,决定是否能够成键,其他原则只影响成键效率。如图,s轨道和p轨道重叠,由于对称性不匹配,p轨道上下符号相异,重叠的结果等于零。3关于反键轨道(1)反键轨道是整个分子轨道不可或缺的组成部分,几乎占总分子轨道数的一半。(2)反键轨道与成键轨道性质相似,也必须按照Pauli不相容原理、能量最低原理和Hund规则填充电子。(3)反键轨道并不是总处于排斥的状态。(4)反键轨道是了解分子激发态性质的关键。3.3.2分子轨道的分类和分布特点1轨道和键2轨道和键3轨道和键电子云头对头重叠,正重叠(波函数相加)为成键轨道,负重叠(波函数相减)为反键轨道。电子云肩并肩重叠。电子云面对面重叠。轨道:有包含键轴的一个节面轨道:有包含键轴的两个节面轨道:绕键轴柱状对称3.3.3同核双原子分子的结构分子轨道理论示例:氢分子的分子轨道理论计算RrrrrrHbaba11112112ˆ1222221121在BO近似下,能量算符为:在单电子近似下,能量被近似分为两个单电子能量和21222222111121ˆˆ)r(112)r(112ˆHHVrrVrrHbaba近似外场采用LCAO-MO近似,分子轨道表示为原子轨道的线性叠加:baicc21波函数近似写为:)2()1()2,1(21薛定谔方程简化为:)2()2(ˆ);1()1(ˆ22221111EHEH为了使计算尽可能简单,我们不采用自洽场方法来计算近似的外场,而简单取:V1=V2=1/(2R),这样两个电子的薛定谔方程是一样的,只要解一个即可。其中a和b是两个氢原子的1s轨道。这样就可以采用变分法定出分子轨道表达式中的两个待定常数。求解过程与氢分子离子的求解过程类似。根据泡利原理,电子的波函数应为反对称的,而且应该计及电子自旋,合格的波函数应该写成完全波函数的形式。abbaS22IabbaS22II单电子波函数有两解:波函数对称)1,2()2,1(22)]2()2()][1()1([)2()1()2,1(IIabbabaS根据泡利不相容原理,每个轨道可以容纳两个电子;在基态时,电子优先填入能量低的轨道。IIIEE氢分子的完全波函数也可用Slater行列式写:)2()2()2()2()1()1()1()1(21)2,1(IIII如果用分子轨道的符号来写,显然I是由两个1s轨道叠加形成的成键轨道,那么1sI)2()2()2()2()1()1()1()1(21)2,1(1s1s1s1s1电子组态按照能量相近、对称性匹配和电子云最大重叠这三个原则,两个原子中满足成键三原则的原子轨道可以组成分子轨道。例:一个氧原子的2px轨道可以和另一氧原子的2px轨道组成键,但一个氧原子的2px轨道不会和另一氧原子的2py轨道成键,因为不满足对称性匹配原则,一个氧原子的2s轨道也不会和另一氧原子的1s轨道成键,因为不满足能量相近原则。分子轨...