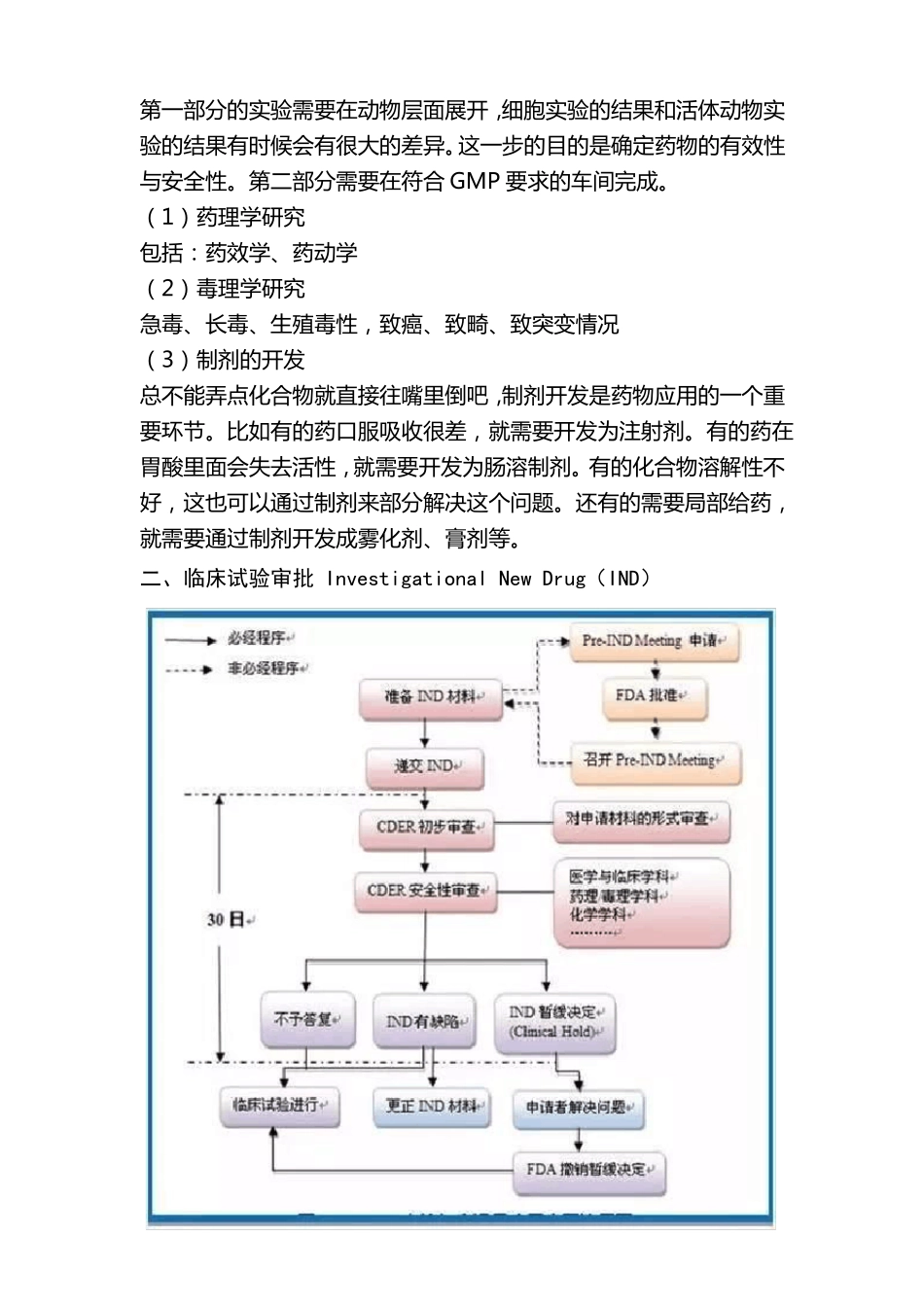
新药从研发到上市需经过哪些流程?10 年时间,花费 10 亿美元,研发一款新药,无论是利益的驱动,还是拯救万千患者的成就感,药企的这一行为都值得我们尊敬。一款新药从研发到上市都需要经过哪些流程?每一步又有哪些经验可以借鉴?本文以小分子药物为例,试着做了一个梳理,希望能对你有所帮助。一、临床前研究1、研究开发(一般 2-3 年)实验室研究,寻找治疗特定疾病的具有潜力的新化合物(1)药物靶点的发现及确认这是所有工作的起点,只有确定了靶点,后续所有的工作才有展开的依据。(2)化合物的筛选与合成根据靶点的空间结构,从虚拟化合物库中筛选一系列可匹配的分子结构,合成这些化合物,它们被称为先导化合物。(3)活性化合物的验证与优化不是所有先导化合物都能符合要求,在这个阶段需要通过体外细胞试验验证,初步筛选出活性高、毒性低的化合物,并根据构效关系进行结构优化,这些化合物称为药物候选物。同时也存在一个化合物对目标 A 靶点没有作用,却有可能对其他的B 靶点、C 靶点有非常好活性的情况,暂且不表。2、临床前实验(一般 2-4 年)这一阶段目的,一是评估药物的药理和毒理作用,药物的吸收、分布、代谢和排泄情况(ADME)。二是进行生产工艺、质量控制、稳定性等研究(CMC)。第一部分的实验需要在动物层面展开,细胞实验的结果和活体动物实验的结果有时候会有很大的差异。这一步的目的是确定药物的有效性与安全性。第二部分需要在符合 GMP 要求的车间完成。(1)药理学研究包括:药效学、药动学(2)毒理学研究急毒、长毒、生殖毒性,致癌、致畸、致突变情况(3)制剂的开发总不能弄点化合物就直接往嘴里倒吧,制剂开发是药物应用的一个重要环节。比如有的药口服吸收很差,就需要开发为注射剂。有的药在胃酸里面会失去活性,就需要开发为肠溶制剂。有的化合物溶解性不好,这也可以通过制剂来部分解决这个问题。还有的需要局部给药,就需要通过制剂开发成雾化剂、膏剂等。二、临床试验审批 Investigational New Drug(IND)三、临床试验(一般 3-7 年)人体试验共分三期:• Ⅰ期临床 20-100 例,正常人,主要进行安全性评价。• Ⅱ期临床 100-300 例,病人,主要进行有效性评价 。• Ⅲ期临床 300-5000 例,病人,扩大样本量,进一步评价。因为 Ⅰ-Ⅲ 期临床在整个药物研发过程中非常重要,我们重点讲一下这部分。传统意义上,新药的临床研究分为I/II/III期,后来 II 期有分成 IIa...