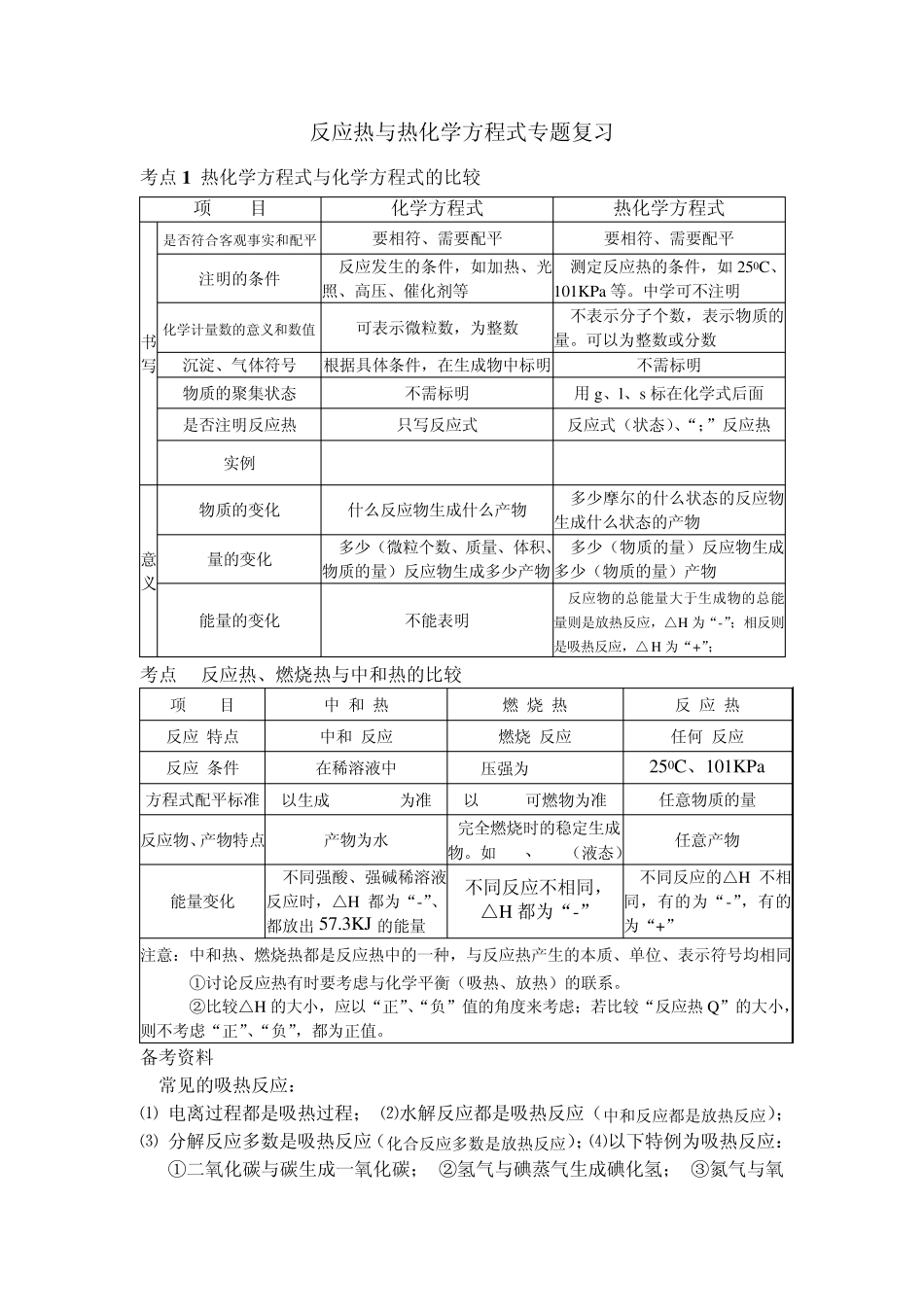
反应热与热化学方程式专题复习 考点1 热化学方程式与化学方程式的比较 项 目 化学方程式 热化学方程式 书写 是否符合客观事实和配平 要相符、需要配平 要相符、需要配平 注明的条件 反应发生的条件,如加热、光照、高压、催化剂等 测定反应热的条件,如250C、101KPa 等。中学可不注明 化学计量数的意义和数值 可表示微粒数,为整数 不表示分子个数,表示物质的量。可以为整数或分数 沉淀、气体符号 根据具体条件,在生成物中标明 不需标明 物质的聚集状态 不需标明 用g、l、s 标在化学式后面 是否注明反应热 只写反应式 反应式(状态)、“;”反应热 实例 意义 物质的变化 什么反应物生成什么产物 多少摩尔的什么状态的反应物生成什么状态的产物 量的变化 多少(微粒个数、质量、体积、物质的量)反应物生成多少产物 多少(物质的量)反应物生成多少(物质的量)产物 能量的变化 不能表明 反应物的总能量大于生成物的总能量则是放热反应,△H 为“-”;相反则是吸热反应,△ H 为“+”; 考点2 反应热、燃烧热与中和热的比较 项 目 中 和 热 燃 烧 热 反 应 热 反应 特点 中和 反应 燃烧 反应 任何 反应 反应 条件 在稀溶液中 压强为101KPa 250C、101KPa 方程式配平标准 以生成1molH2O为准 以1mol可燃物为准 任意物质的量 反应物、产物特点 产物为水 完全燃烧时的稳定生成物。如CO2、H2O(液态) 任意产物 能量变化 不同强酸、强碱稀溶液反应时,△H 都为“-”、都放出 57.3KJ 的能量 不同反应不相同, △H 都为“-” 不同反应的△H 不相同,有的为“-”,有的为“+” 注意:中和热、燃烧热都是反应热中的一种,与反应热产生的本质、单位、表示符号均相同①讨论反应热有时要考虑与化学平衡(吸热、放热)的联系。 ②比较△H 的大小,应以“正”、“负”值的角度来考虑;若比较“反应热Q”的大小,则不考虑“正”、“负”,都为正值。 备考资料 1 常见的吸热反应: ⑴ 电离过程都是吸热过程; ⑵水解反应都是吸热反应(中和反应都是放热反应); ⑶ 分解反应多数是吸热反应(化合反应多数是放热反应);⑷以下特例为吸热反应: ①二氧化碳与碳生成一氧化碳; ②氢气与碘蒸气生成碘化氢; ③氮气与氧气生成一氧化氮; ④碳与水蒸气生成一氧化碳和氢气。 2 影响反应热大小的因素 ⑴ 等物质的量的不同金属和非金属与同种物质反应,金属和非...