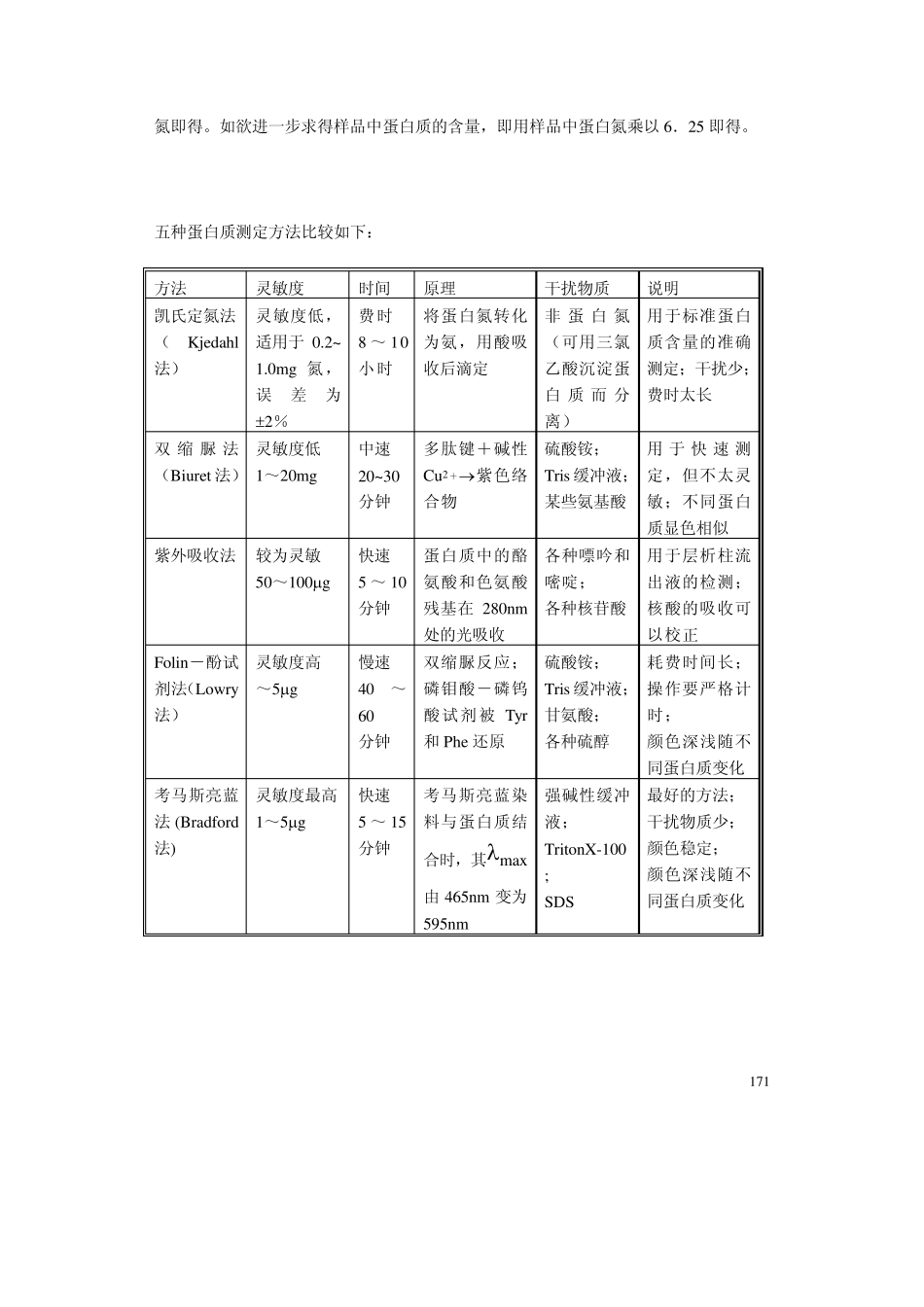
170 〔Ⅱ〕 实验部分 实验一 蛋白质含量测定法 本实验的目的是学会各种蛋白质含量的测定方法。了解各种测定方法的基本原理和优缺点。 蛋白质含量测定法,是生物化学研究中最常用、最基本的分析方法之一。目前常用的有四种古老的经典方法,即定氮法,双缩尿法(Biuret 法)、Folin-酚试剂法(Lowry法)和紫外吸收法。另外还有一种近十年才普遍使用起来的新的测定法,即考马斯亮蓝法(Bradford 法)。其中 Bradford 法和 Lowry法灵敏度最高,比紫外吸收法灵敏 10~20倍,比 Biuret 法灵敏 100 倍以上。定氮法虽然比较复杂,但较准确,往往以定氮法测定的蛋白质作为其他方法的标准蛋白质。 值得注意的是,这后四种方法并不能在任何条件下适用于任何形式的蛋白质,因为一种蛋白质溶液用这四种方法测定,有可能得出四种不同的结果。每种测定法都不是完美无缺的,都有其优缺点。在选择方法时应考虑:①实验对测定所要求的灵敏度和精确度;②蛋白质的性质;③溶液中存在的干扰物质;④测定所要花费的时间。 考马斯亮蓝法(Bradford 法),由于其突出的优点,正得到越来越广泛的应用。 一、微量凯氏(Kjeldahl)定氮法 样品与浓硫酸共热。含氮有机物即分解产生氨(消化),氨又与硫酸作用,变成硫酸氨。经强碱碱化使之分解放出氨,借蒸汽将氨蒸至酸液中,根据此酸液被中和的程度可计算得样品之氮含量。若以甘氨酸为例,其反应式如下: CH2COOH + 3H2SO4 2CO2 + 3SO2 +4H2O +NH3 (1) NH2 2NH3 + H2SO4 (NH4)2SO4 (2) (NH4)2SO4 + 2NaOH 2H2O +Na2SO4 + 2NH3 (3) 反应(1)、(2)在凯氏瓶内完成,反应(3)在凯氏蒸馏装置中进行。 为了加速消化,可以加入 CuSO4 作催化剂,K2SO4 以提高溶液的沸点。收集氨可用硼酸溶液,滴定则用强酸。实验和计算方法这里从略。 计算所得结果为样品总氮量,如欲求得 样品中蛋白含量,应将总氮量减去非蛋白 171 氮即得。如欲进一步求得样品中蛋白质的含量,即用样品中蛋白氮乘以 6.25 即得。 五种蛋白质测定方法比较如下: 方法 灵敏度 时间 原理 干扰物质 说明 凯氏定氮法 (Kjedahl法) 灵敏度低,适用于 0.2~ 1.0mg 氮,误差为 2% 费时 8 ~ 10小时 将蛋白氮转化为氨,用酸吸收后滴定 非 蛋 白 氮(可用三氯乙酸沉淀蛋白 质 而 分离) 用于标准蛋白质含量的准确测定;干扰少;费时太长 双 缩 脲 法(Biuret ...