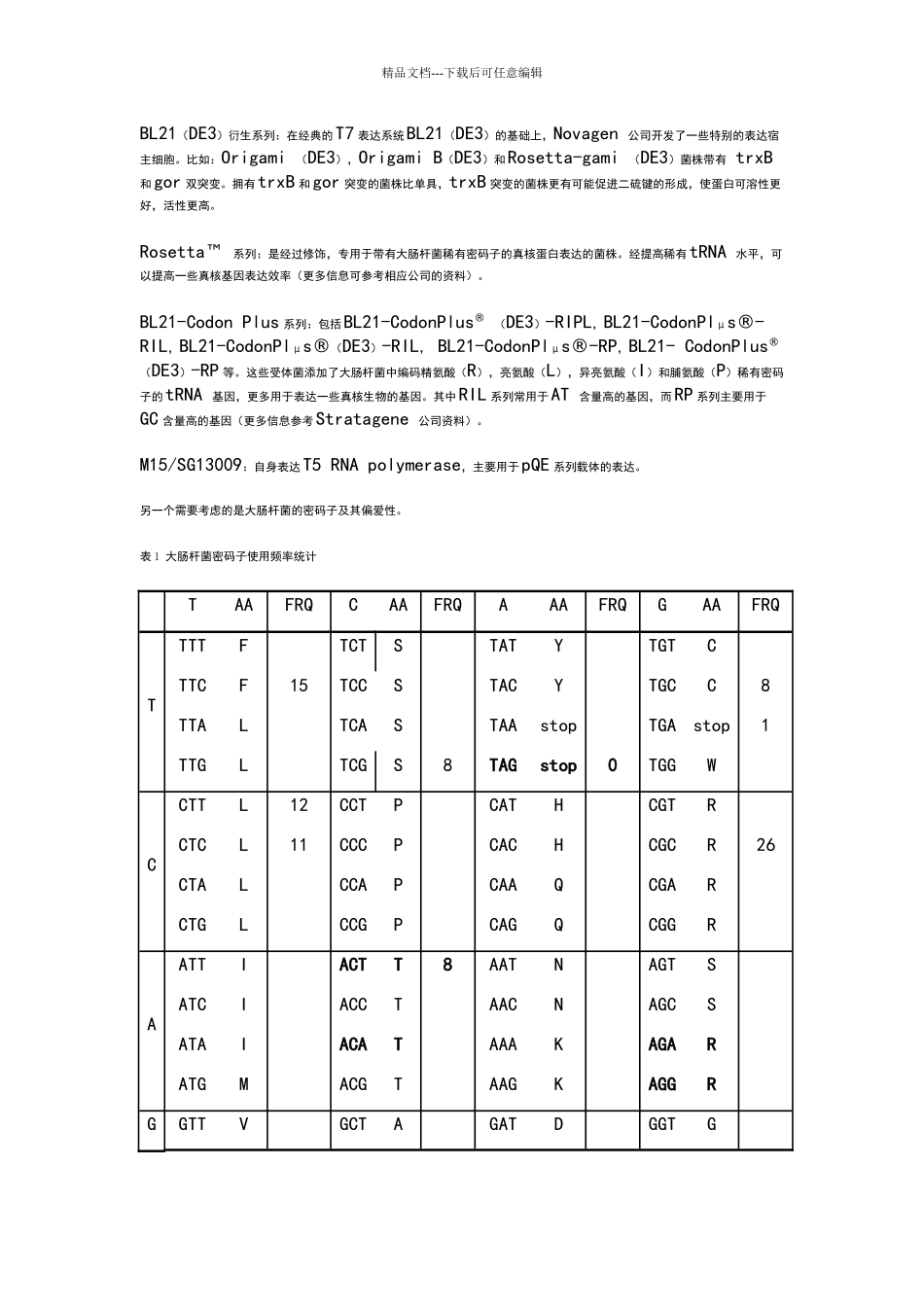
精品文档---下载后可任意编辑8.大肠杆菌表达系统与蛋白表达纯化大肠杆菌表达系统遗传背景清楚,目的基因表达水平高,培育周期短,抗污染能力强等特点, 是分子生物学讨论和生物技术产业化进展进程中的重要工具。因此熟练掌握并运用大肠杆菌表达系统的基本原理和常规操作是对每一个讨论生来说是非常必要的。本章节介绍了实验室常用的大肠杆菌表达系统的构成特点,归纳了利用大肠杆菌表达系统纯化重组蛋白的基本流程和详细操作步骤,并且结合笔者的操作经验,总结了初学者在操作过程中可能遇到的问题和解决策略。大肠杆菌表达系统的选择与构建8.1.1 表达载体的选择根据启动子的不同这些载体大致可以分为热诱导启动子,如λPL,cspA 等和另外一类就是广泛使用的IPTG 诱导的启动子,如lac,trc,tac,T5/lac operator,T5/lac operator 等。根据表达蛋白质的类型可分为单纯表达载体和融合表达载体。融合表达是在目标蛋白的N 端或C 端添加特别的序列,以提高蛋白的可溶性,促进蛋白的正确折叠,实现目的蛋白的快速亲和纯化,或者实现目标蛋白的表达定位。常用的用于亲和纯化融合标签包括 Poly-Arg,Poly-His, Strep-Tag Ⅱ,S-tag,MBP 等。其中His-Tag 和GST-Tag 是目前使用最多的。His Tag 大多数是连续的六个His 融合于目标蛋白的N 端或C 端,通过His 与金属离子:Cu2+>Fe2+>Zn2+>Ni2+ 的螯合作用而实现亲和纯化,其中Ni2+是目前使用最广泛的。His 标签具有较小的分子量,融合于目标蛋白的N 端和C 端不影响目标蛋白的活性,因此纯化过程中大多不需要去除。目前常使用的表达载体主要是由Novagen 提供的pET 系列和 Qiagen 公司提供的pQE 系列。除了His 标签外,还原性谷胱甘肽S-转移酶是另一种实验室常用的融合标签。它可以通过还原性谷胱甘肽琼脂糖亲和层析而快速纯化。此外,与His 相比,GST 很多时候能够促进目标蛋白的正确折叠,提高目标蛋白表达的可溶性,因此,对于那些用his 标签表达易形成包涵体的蛋白,可以尝试用GST 融合表达来改进。当然,GST 具有较大的分子量(26kDa),可能对目的蛋白的活性有影响,因此很多时候切除GST 是必须的。目前,GST 融合表达系统主要是由GE Healthcare(原Amersham)提供。8.1.2 宿主菌的选择重组质粒的构建一般选择遗传稳定,转化效率高,质粒产量高的菌株作为受体菌,常用的有 DH5α, JM 109, DH 10B , NovaBlμe 等recA–和endA–型细胞。作为表达宿主菌...