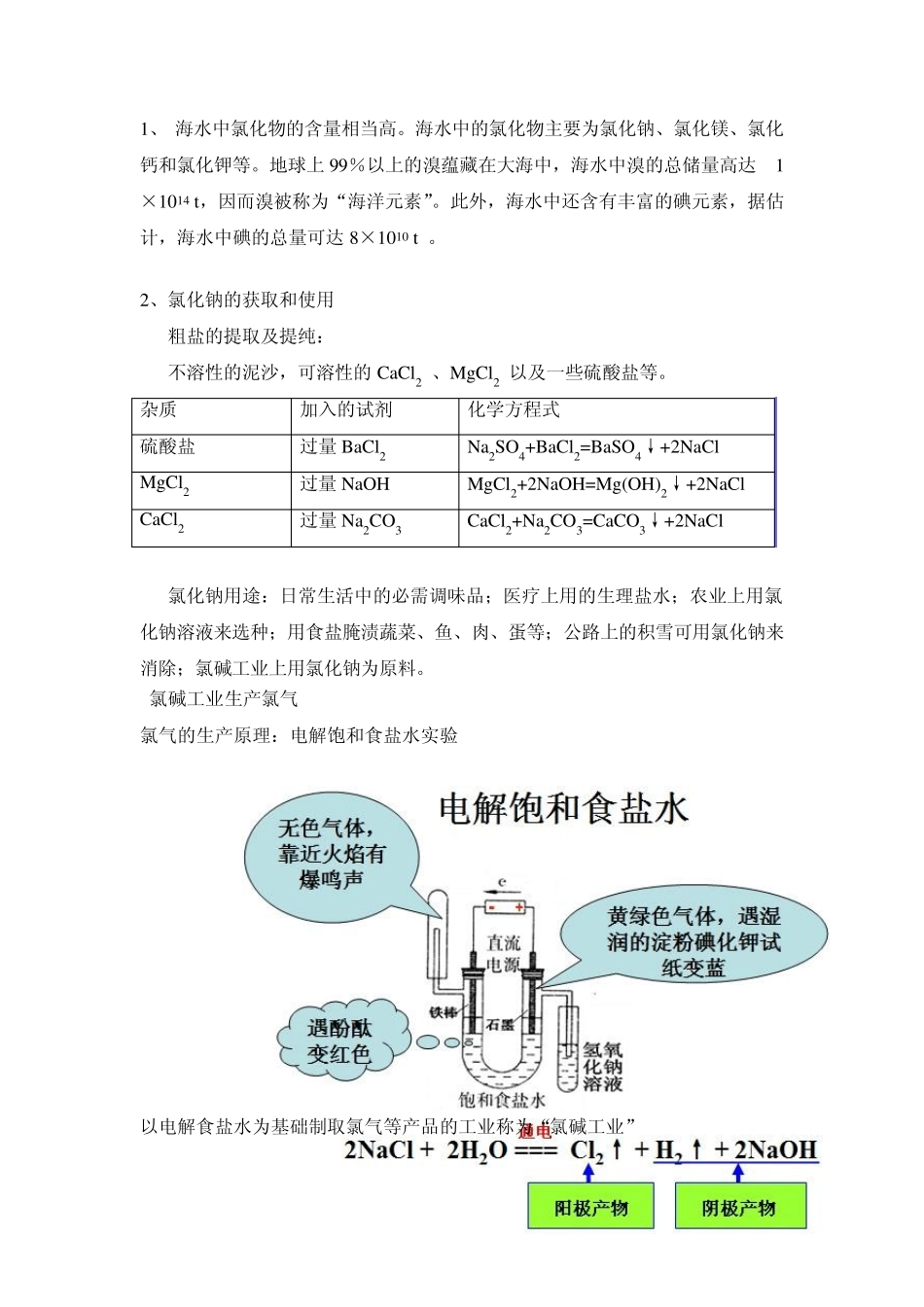
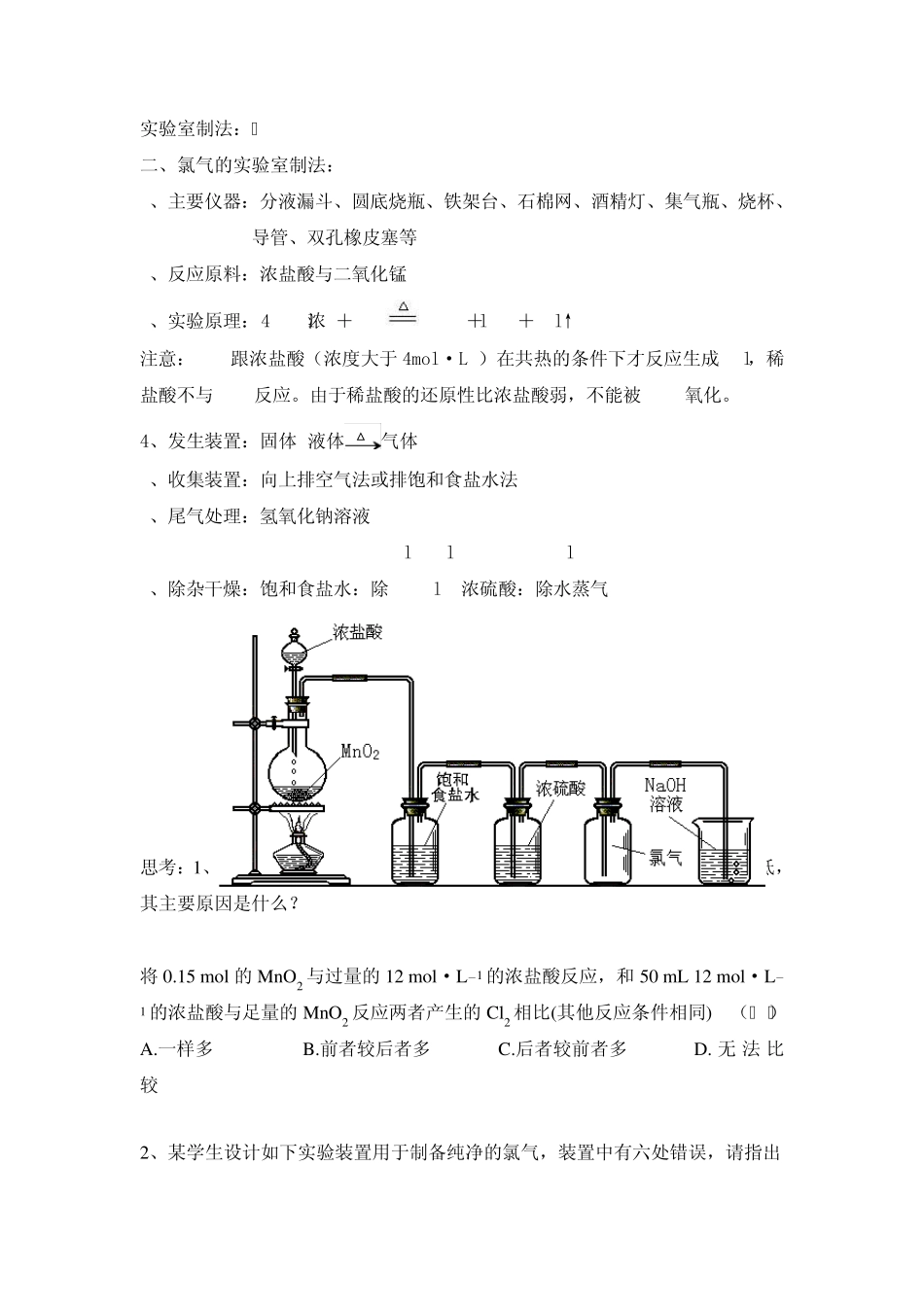
1、 海水中氯化物的含量相当高。海水中的氯化物主要为氯化钠、氯化镁、氯化钙和氯化钾等。地球上99%以上的溴蕴藏在大海中,海水中溴的总储量高达 1×1014 t,因而溴被称为“海洋元素”。此外,海水中还含有丰富的碘元素,据估计,海水中碘的总量可达8×1010 t 。 2、氯化钠的获取和使用 粗盐的提取及提纯: 不溶性的泥沙,可溶性的CaCl2 、MgCl2 以及一些硫酸盐等。 杂质 加入的试剂 化学方程式 硫酸盐 过量BaCl2 Na2SO4+BaCl2=BaSO4↓+2NaCl MgCl2 过量NaOH MgCl2+2NaOH=Mg(OH)2↓+2NaCl CaCl2 过量Na2CO3 CaCl2+Na2CO3=CaCO3↓+2NaCl 氯化钠用途:日常生活中的必需调味品;医疗上用的生理盐水;农业上用氯化钠溶液来选种;用食盐腌渍蔬菜、鱼、肉、蛋等;公路上的积雪可用氯化钠来消除;氯碱工业上用氯化钠为原料。 氯碱工业生产氯气 氯气的生产原理:电解饱和食盐水实验 以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业” 实验室制法: 二、氯气的实验室制法: 1、主要仪器:分液漏斗、圆底烧瓶、铁架台、石棉网、酒精灯、集气瓶、烧杯、导管、双孔橡皮塞等 2、反应原料:浓盐酸与二氧化锰 3、实验原理:4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑ 注意:MnO2跟浓盐酸(浓度大于4mol·L-1)在共热的条件下才反应生成 Cl2,稀盐酸不与MnO2反应。由于稀盐酸的还原性比浓盐酸弱,不能被 MnO2氧化。 4、发生装置:固体+液体△ 气体 5、收集装置:向上排空气法或排饱和食盐水法 6、尾气处理:氢氧化钠溶液 2NaOH + Cl2 = NaCl + NaClO + H2O 7、除杂干燥:饱和食盐水:除 HCl 浓硫酸:除水蒸气 思考:1、使用浓盐酸与足量的MnO2 共热制Cl2,实际产生的Cl2 总比理论值低,其主要原因是什么? 将0.15 mol 的MnO2 与过量的12 mol·L-1 的浓盐酸反应,和 50 mL 12 mol·L-1 的浓盐酸与足量的MnO2 反应两者产生的Cl2 相比(其他反应条件相同)( ) A.一样多 B.前者较后者多 C.后者较前者多 D. 无 法比较 2、某学生设计如下实验装置用于制备纯净的氯气,装置中有六处错误,请指出 氯气的性质: 化学史话:2 0 0 9 年9 月1 6 日晚,在委内瑞拉东部,一辆满载液氯的液罐车和对面货车相撞 ,大量液氯外泄。据目击者描述 : “一股黄绿色的气体 „唰‟ 地射向高空,并有刺鼻的气味” 。 事发后消防队员不断地用水枪喷射,但氯气迅速扩散 ,导致至少 8 人中...