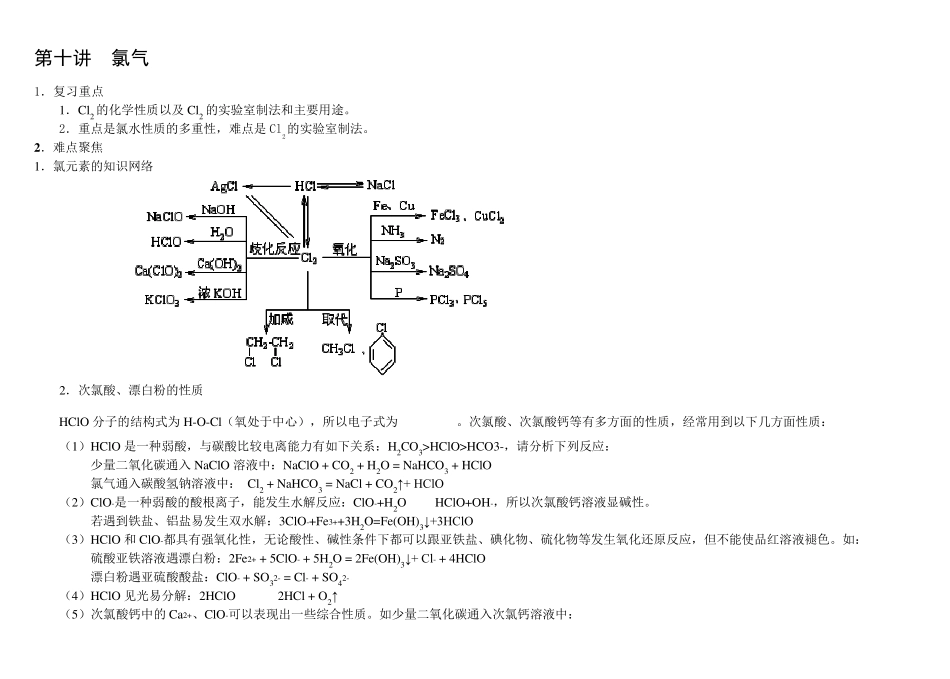
第十讲 氯气 1.复习重点 1.Cl2 的化学性质以及Cl2 的实验室制法和主要用途。 2.重点是氯水性质的多重性,难点是Cl2的实验室制法。 2 .难点聚焦 1.氯元素的知识网络 2.次氯酸、漂白粉的性质 HClO 分子的结构式为 H-O-Cl(氧处于中心),所以电子式为 。次氯酸、次氯酸钙等有多方面的性质,经常用到以下几方面性质: (1)HClO 是一种弱酸,与碳酸比较电离能力有如下关系:H2CO3>HClO>HCO3-,请分析下列反应: 少量二氧化碳通入 NaClO 溶液中:NaClO + CO2 + H2O = NaHCO3 + HClO 氯气通入碳酸氢钠溶液中: Cl2 + NaHCO3 = NaCl + CO2↑+ HClO (2)ClO-是一种弱酸的酸根离子,能发生水解反应:ClO-+H2O HClO+OH-,所以次氯酸钙溶液显碱性。 若遇到铁盐、铝盐易发生双水解:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO (3)HClO 和ClO-都具有强氧化性,无论酸性、碱性条件下都可以跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。如: 硫酸亚铁溶液遇漂白粉:2Fe2+ + 5ClO- + 5H2O = 2Fe(OH)3↓+ Cl- + 4HClO 漂白粉遇亚硫酸酸盐:ClO- + SO32- = Cl- + SO42- (4)HClO 见光易分解:2HClO 2HCl + O2↑ (5)次氯酸钙中的Ca2+、ClO-可以表现出一些综合性质。如少量二氧化碳通入次氯钙溶液中: Ca(ClO)2 + CO2 + H2O = CaCO3↓ + 2HClO 注 意 理 解 二 氧 化 碳 、 碳 酸 钠 、 碳 酸 氢 钠 分 别 跟 次 氯 酸 钙 溶 液 反 应 的 差 异 : Ca(ClO)2 + Na2CO3 = CaCO3↓ + 2NaClO Ca(ClO)2 + NaHCO3 = CaCO3↓ + HClO + NaClO 3 . 例 题 精 讲 例 1: 下 列 物 质 中 , 能 使 紫 色 石 蕊 试 液 因 漂 白 而 褪 色 的 是 ( ) A. B. 活 性 炭 C. 氯 水 D. 盐 酸 选 题 角 度 : 考 查 氯 气 的 性 质 。 此 题 学 生 往 往 因 不 清 楚 在 酸 性 、 碱 性 条 件 下 均 具 有 氧 化 性 , 从 而 具 有 漂 白 能 力 而 失 分 。 解 析 : 具 有 漂 白 作 用 , 能 使 紫 色 石 蕊 试 液 褪 色 , A 正 确 ; 活 性 碳 具 有 吸 附 作 用 ( 物 理 现 象 ) , 能 吸 附 有 机 色 素 等 , 故 B 不 正 确 ; 盐 酸 是 一 种 常 见...