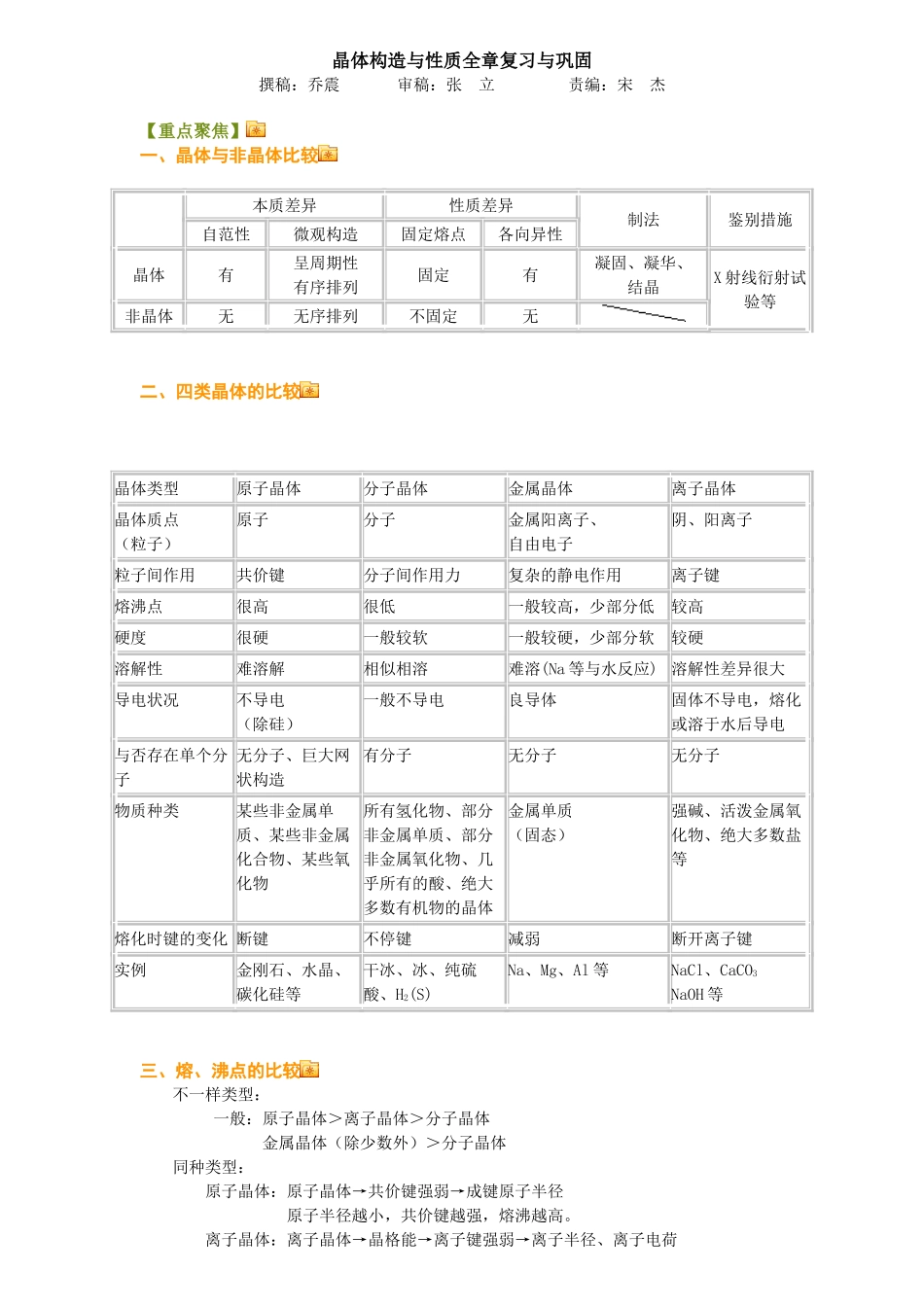
晶体构造与性质全章复习与巩固撰稿:乔震 审稿:张 立 责编:宋 杰【重点聚焦】一、晶体与非晶体比较 本质差异 性质差异 制法 鉴别措施 自范性 微观构造 固定熔点 各向异性 晶体 有 呈周期性有序排列固定 有 凝固、凝华、结晶X 射线衍射试验等 非晶体 无 无序排列 不固定 无 二、四类晶体的比较晶体类型 原子晶体 分子晶体 金属晶体 离子晶体 晶体质点(粒子) 原子 分子 金属阳离子、自由电子 阴、阳离子 粒子间作用 共价键 分子间作用力 复杂的静电作用 离子键 熔沸点 很高 很低 一般较高,少部分低 较高 硬度 很硬 一般较软 一般较硬,少部分软 较硬 溶解性 难溶解 相似相溶 难溶(Na 等与水反应) 溶解性差异很大 导电状况 不导电(除硅) 一般不导电 良导体 固体不导电,熔化或溶于水后导电 与否存在单个分子 无分子、巨大网状构造 有分子 无分子 无分子 物质种类 某些非金属单质、某些非金属化合物、某些氧化物 所有氢化物、部分非金属单质、部分非金属氧化物、几乎所有的酸、绝大多数有机物的晶体 金属单质(固态) 强碱、活泼金属氧化物、绝大多数盐等 熔化时键的变化 断键 不停键 减弱 断开离子键 实例 金刚石、水晶、碳化硅等 干冰、冰、纯硫酸、H2(S) Na、Mg、Al 等 NaCl、CaCO3NaOH 等 三、熔、沸点的比较 不一样类型: 一般:原子晶体>离子晶体>分子晶体 金属晶体(除少数外)>分子晶体 同种类型: 原子晶体:原子晶体→共价键强弱→成键原子半径 原子半径越小,共价键越强,熔沸越高。 离子晶体:离子晶体→晶格能→离子键强弱→离子半径、离子电荷 离子所带电荷数越多,离子半径越小,离子键越强、熔沸点越高 金属晶体:金属晶体→金属键强弱→金属阳离子半径、所带电荷数 金属阳离子电荷数越多,离子半径越小,金属键越强、熔沸点越高 分子晶体:①构成和构造相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高 ②式量相似,分子极性越大,熔沸点越高 ③分子中存在氢键的比不存在氢键的熔沸点高四、几种经典晶体的空间构造1、氯化钠晶体 氯化钠晶体中阴、阳离子的配位数是 6,即每个 Na+紧邻 6 个 Cl-,这些 Cl-构成的几何图形是正八面体;每个 Na+与 12 个 Na+等距离相邻。平均每个氯化钠晶胞具有 4 个 Na+和 4个 Cl-2、氯化铯晶体 每个 Cl-(或 Cs+)周围与之最靠近且距离相等的 Cs+(或 Cl-)共...