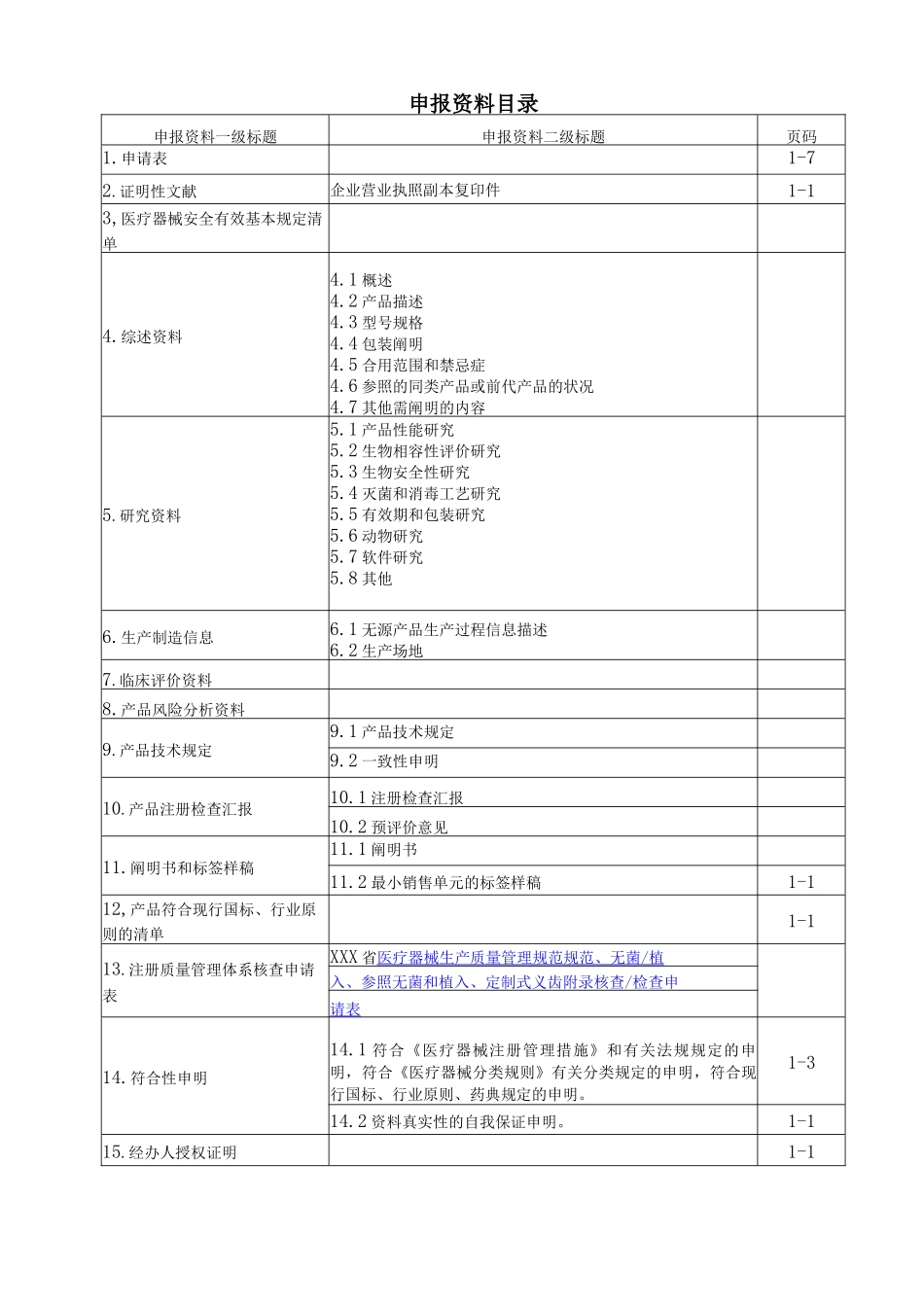
申报资料目录申报资料一级标题申报资料二级标题页码1.申请表1-72.证明性文献企业营业执照副本复印件1-13,医疗器械安全有效基本规定清单4.综述资料4.1 概述4.2 产品描述4.3 型号规格4.4 包装阐明4.5 合用范围和禁忌症4.6 参照的同类产品或前代产品的状况4.7 其他需阐明的内容5.研究资料5.1 产品性能研究5.2 生物相容性评价研究5.3 生物安全性研究5.4 灭菌和消毒工艺研究5.5 有效期和包装研究5.6 动物研究5.7 软件研究5.8 其他6.生产制造信息6.1 无源产品生产过程信息描述6.2 生产场地7.临床评价资料8.产品风险分析资料9.产品技术规定9.1 产品技术规定9.2 一致性申明10.产品注册检查汇报10.1 注册检查汇报10.2 预评价意见11.阐明书和标签样稿11.1 阐明书11.2 最小销售单元的标签样稿1-112,产品符合现行国标、行业原则的清单1-113.注册质量管理体系核查申请表XXX 省医疗器械生产质量管理规范规范、无菌 / 植 入、参照无菌和植入、定制式义齿附录核查/检查申请表14.符合性申明14.1 符合《医疗器械注册管理措施》和有关法规规定的申明,符合《医疗器械分类规则》有关分类规定的申明,符合现行国标、行业原则、药典规定的申明。1-314.2 资料真实性的自我保证申明。1-115.经办人授权证明1-1XXX 省第二类医疗器械注册申请表产品名称: 一次性使用透析护理包 注册申请人: _________________ ___________________ 填表阐明1. 本表合用于 XXX 省第二类医疗器械(除体外诊断试剂)拟上市产品注册及延续注册事项的申请。2. 本申请表应打印。填写内容应完整、清晰、整洁,不得涂改。3. 申报产品名称、规格型号应与所提交的产品技术规定等申报材料中所用名称、规格型号一致。4. 根据申请注册种类,在本表“注册形式”等栏有关类型前方框内用“√”做标识。5. 按照规定报送的有关申请材料,在“注册申请材料及次序”栏对应项目资料左侧方框内划“√”,如根据有关规定,无需提交资料的,请在该项目左侧的方框内划“#”,并阐明理由。6. 注册审评审批过程中如申请表内容有修改,应重新提交修改后的申请表。7.申报资料一式一份。产品名称一次性使用透析护理包构造特征无源有源规格、型号/注册形式拟上市产品注册延续注册注册申请人名称组织机构代码许可证号注册申请人住所邮政编码生产地址邮政编码联络人职位手机号码联络电话法人代表签字:联络电话原注册证号注册证有效期至至年月曰产品重要构造及构成一次性使用...