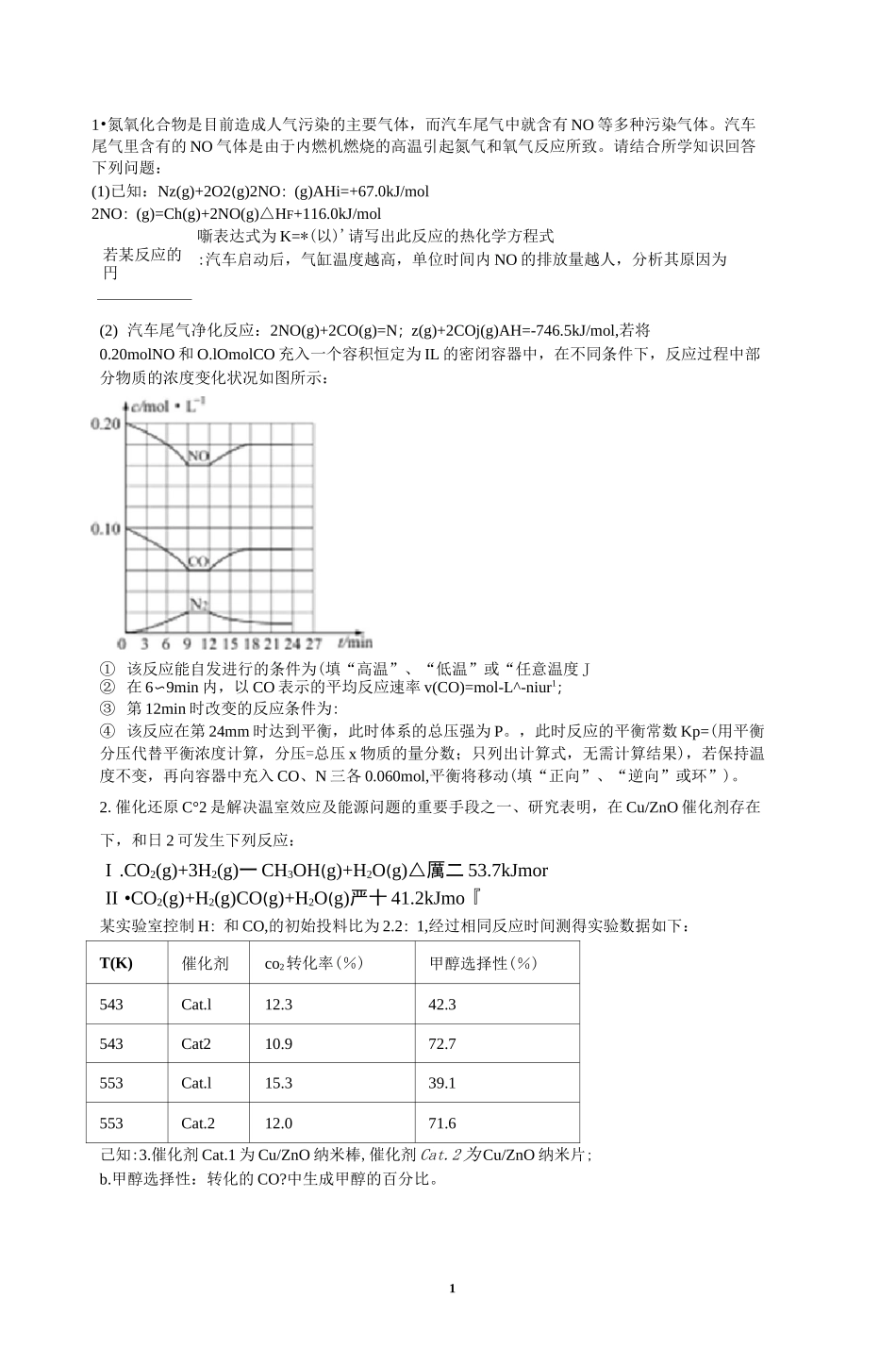
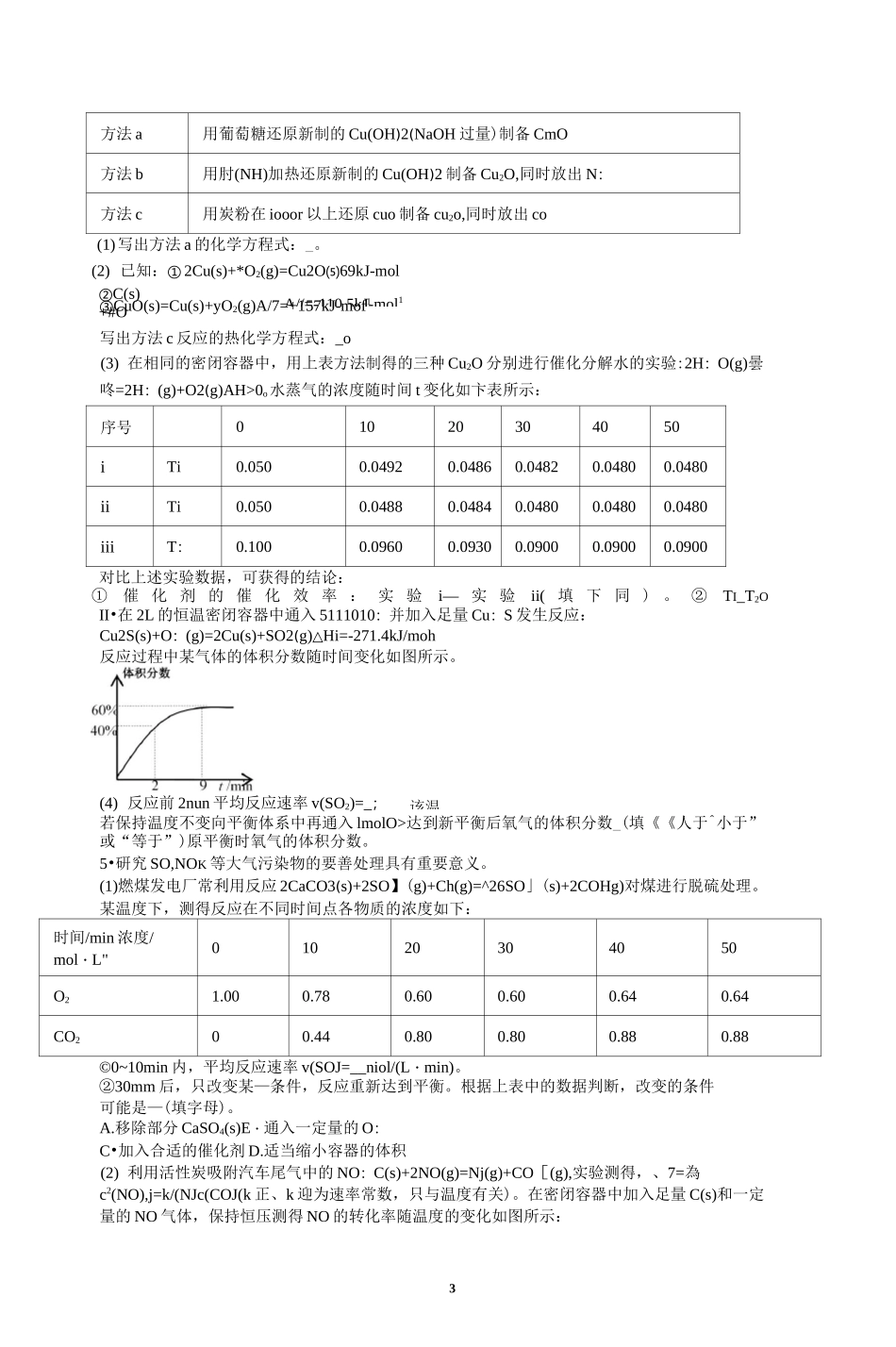
11•氮氧化合物是目前造成人气污染的主要气体,而汽车尾气中就含有 NO 等多种污染气体。汽车尾气里含有的 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致。请结合所学知识回答下列问题:(1)已知:Nz(g)+2O2(g)2NO:(g)AHi=+67.0kJ/mol2NO:(g)=Ch(g)+2NO(g)△HF+116.0kJ/mol若某反应的円噺表达式为 K=*(以)'请写出此反应的热化学方程式:汽车启动后,气缸温度越高,单位时间内 NO 的排放量越人,分析其原因为(2) 汽车尾气净化反应:2NO(g)+2CO(g)=N;z(g)+2COj(g)AH=-746.5kJ/mol,若将0.20molNO 和 O.lOmolCO 充入一个容积恒定为 IL 的密闭容器中,在不同条件下,反应过程中部分物质的浓度变化状况如图所示:① 该反应能自发进行的条件为(填“高温”、“低温”或“任意温度 J② 在 6〜9min 内,以 CO 表示的平均反应速率 v(CO)=mol-L^-niur1;③ 第 12min 时改变的反应条件为:④ 该反应在第 24mm 时达到平衡,此时体系的总压强为 P。,此时反应的平衡常数 Kp=(用平衡分压代替平衡浓度计算,分压=总压 x 物质的量分数;只列出计算式,无需计算结果),若保持温度不变,再向容器中充入 CO、N 三各 0.060mol,平衡将移动(填“正向”、“逆向”或环”)。2.催化还原 C°2 是解决温室效应及能源问题的重要手段之一、研究表明,在 Cu/ZnO 催化剂存在下,和日 2 可发生下列反应:I .CO2(g)+3H2(g)一 CH3OH(g)+H2O(g)△厲二 53.7kJmorII •CO2(g)+H2(g)CO(g)+H2O(g)严十 41.2kJmo『某实验室控制 H:和 CO,的初始投料比为 2.2:1,经过相同反应时间测得实验数据如下:T(K)催化剂co2转化率(%)甲醇选择性(%)543Cat.l12.342.3543Cat210.972.7553Cat.l15.339.1553Cat.212.071.6己知:3.催化剂 Cat.1 为 Cu/ZnO 纳米棒,催化剂 Cat.2 为 Cu/ZnO 纳米片;b.甲醇选择性:转化的 CO?中生成甲醇的百分比。2⑴ 反应 I 自发进行的条件是(填“高温自发、“低温自发”或“任何温度下都自发”),反应 I 中的活化能 E(正)(填“>,或 y”)耳逆)。(2) 在恒温密闭容器中发生反应 I 和反应 i【,卞列说法正确的是(填标号)。A. 543K 时,Cat.I 对反应 I【的催化效果比对反应 I 的好B. 压缩容器体枳,可提高反应的转化率,也会使反应 I 的平衡常数增人C. 增大日 2 和 co:的初始投料比,可提高 co:的平衡转化率D. 若保持压强始终为 P,反应物起始投料比相同,CO,平衡转化率减小(3) 实验...