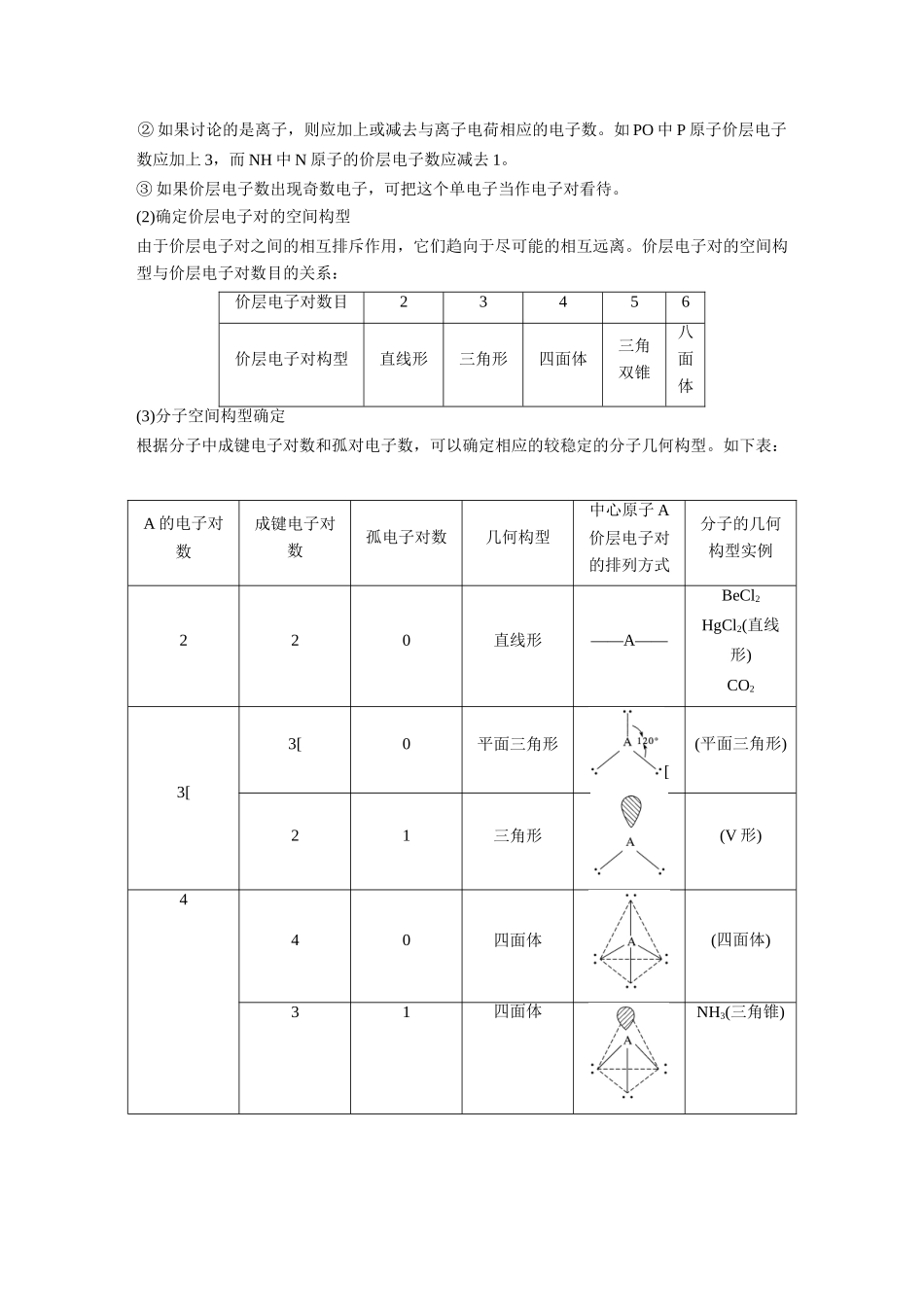
第二节分子的立体结构一、常见分子的空间构型1.双原子分子都是直线形,如:HCl、NO、O2、N2 等。2.三原子分子有直线形,如 CO2、CS2等;还有“V”形,如 H2O、H2S、SO2等。3.四原子分子有平面三角形,如 BF3、BCl3、CH2O 等;有三角锥形,如 NH3、PH3等;也有正四面体,如 P4。4.五原子分子有正四面体,如 CH4、CCl4等,也有不规则四面体,如CH3Cl、CH2Cl2、CHCl3。另外乙烯分子和苯分子都是平面形分子。二、价层电子对互斥模型1.理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。2.价电子对之间的斥力(1)电子对之间的夹角越小,排斥力越大。(2)由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间斥力大小顺序如下:孤电子对-孤电子对>孤电子对-成键电子>成键电子-成键电子(3)由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键。3.价层电子对互斥模型的两种类型价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。(1)当中心原子无孤对电子时,两者的构型一致;(2)当中心原子有孤对电子时,两者的构型不一致。4.用价层电子对互斥理论推断分子或离子的空间构型具体步骤:(1)确定中心原子 A 价层电子对数目中心原子 A 的价电子数与配体 X 提供共用的电子数之和的一半,即中心原子 A 价层电子对数目。计算时注意:① 氧族元素原子作为配位原子时,可认为不提供电子,但作中心原子时可认为它提供所有的 6 个价电子。② 如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。如 PO 中 P 原子价层电子数应加上 3,而 NH 中 N 原子的价层电子数应减去 1。③ 如果价层电子数出现奇数电子,可把这个单电子当作电子对看待。(2)确定价层电子对的空间构型由于价层电子对之间的相互排斥作用,它们趋向于尽可能的相互远离。价层电子对的空间构型与价层电子对数目的关系:价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)分子空间构型确定根据分子中成键电子对数和孤对电子数,可以确定相应的较稳定的分子几何构型。如下表:A 的电子对数成键电子对数孤电子对数几何构型中心原子 A价层电子对的排列方式分子的几何构型...