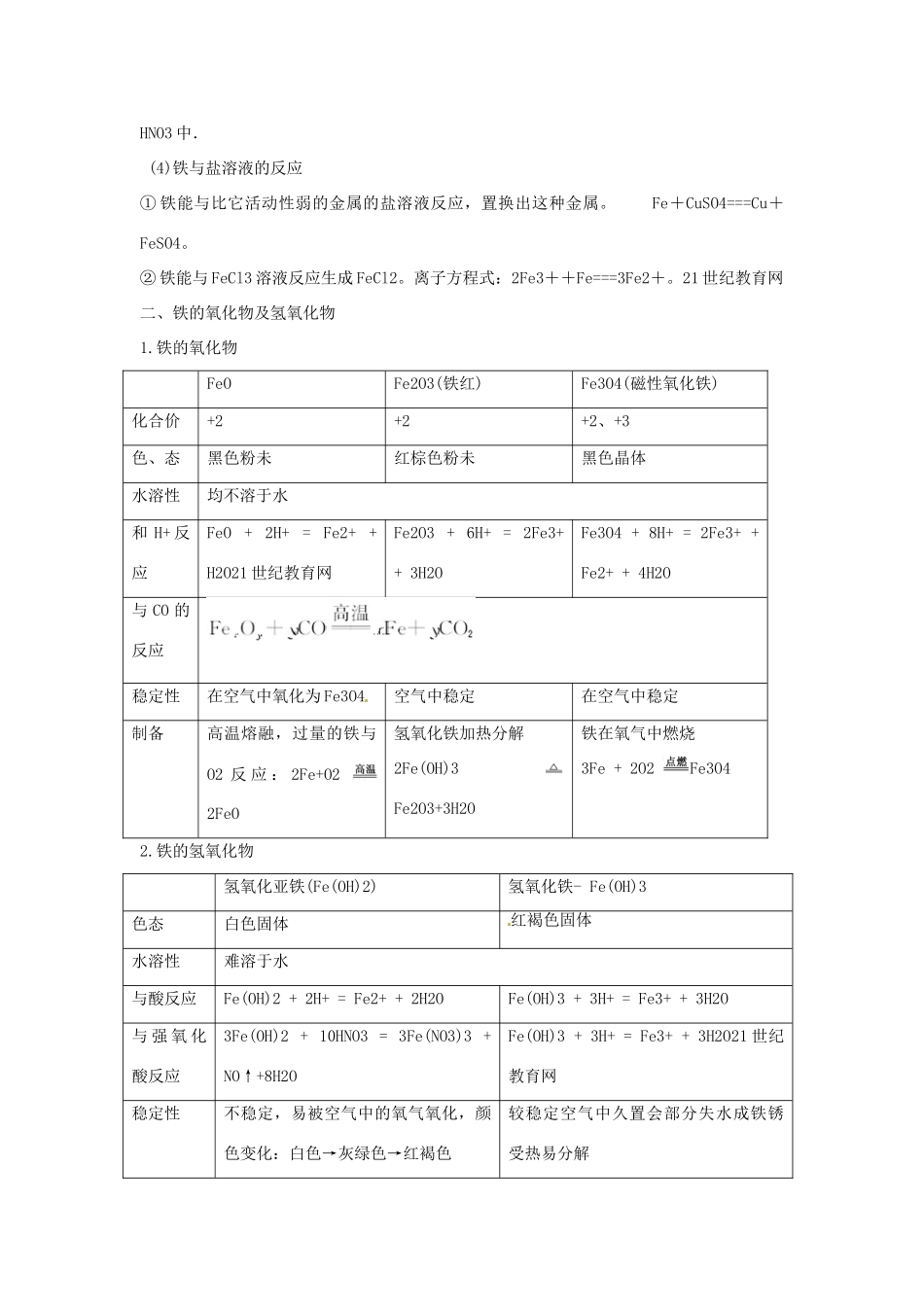
第三节 铁及其重要化合物【高考目标导航】考纲导引考点梳理了解铁及其重要化合物的主要性质及应用1.铁的化学性质。2.铁的氧化物与氢氧化物。【基础知识梳理】一、铁的性质:1.物理性质银白色光泽、密度大,熔沸点高,延展性、导电、导热性较好、能被磁铁吸引。2.化学性质铁是较活泼的金属,铁原子的最外层电子数为 2 个,可失去 2 个或 3 个电子而显+2 价或+3价,但+3 价的化合物较稳定。(1)与非金属反应:3Fe + 2O2Fe3O42Fe + 3C122FeCl3(铁丝在氯气中燃烧时,生成棕黄色的烟,加水振荡后,溶液显黄色)Fe + SFeS说明 铁跟氯气、硫反应时,分别生成+2 价和+3 价的铁,说明氧化性:氯气>硫.(2)与水反应:① 在常温下,在水和空气中的 O2、CO2 等的共同作用下,Fe 易被腐蚀(铁生锈).② 在高温下,铁能与水蒸气反应生成 H2:3Fe + 4H2O(g) Fe3O4 + 4H2(3)与酸反应:[来源:21 世纪教育网]① 与非氧化性酸(如稀盐酸、稀 H2SO4 等)的反应.例如: Fe + 2H+ = Fe2+ + H2↑② 与氧化性酸。a.HNO3(稀)过量时生成 Fe3+:Fe+4HNO3(稀)===Fe(NO3)3+NO↑+2H2O。b.铁粉过量时生成 Fe2+:3Fe+8HNO3(稀)===3Fe(NO3)2+2NO↑+4H2Oc.铁遇到冷的浓 H2SO4、浓 HNO3 时,产生钝化现象,因此金属铁难溶于冷的浓 H2SO4 或浓HNO3 中. (4)铁与盐溶液的反应① 铁能与比它活动性弱的金属的盐溶液反应,置换出这种金属。 Fe+CuSO4===Cu+FeSO4。② 铁能与 FeCl3 溶液反应生成 FeCl2。离子方程式:2Fe3++Fe===3Fe2+。21 世纪教育网二、铁的氧化物及氢氧化物1.铁的氧化物FeOFe2O3(铁红)Fe3O4(磁性氧化铁)化合价+2+2+2、+3色、态黑色粉未红棕色粉未黑色晶体水溶性均不溶于水和 H+ 反应FeO + 2H+ = Fe2+ + H2O21 世纪教育网Fe2O3 + 6H+ = 2Fe3+ + 3H2OFe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O与 CO 的反应稳定性在空气中氧化为 Fe3O4空气中稳定在空气中稳定制备高温熔融,过量的铁与O2 反 应 : 2Fe+O2 2FeO氢氧化铁加热分解2Fe(OH)3 Fe2O3+3H2O铁在氧气中燃烧3Fe + 2O2 Fe3O42.铁的氢氧化物氢氧化亚铁(Fe(OH)2)氢氧化铁- Fe(OH)3色态白色固体红褐色固体水溶性难溶于水与酸反应Fe(OH)2 + 2H+ = Fe2+ + 2H2OFe(OH)3 + 3H+ = Fe3+ + 3H2O与 强 氧 化酸反应3Fe(OH)2 + 10HNO3 = 3Fe(NO3)3 + NO↑+8H2OFe(OH)3 + 3H+ = Fe3+ + 3H2O21...