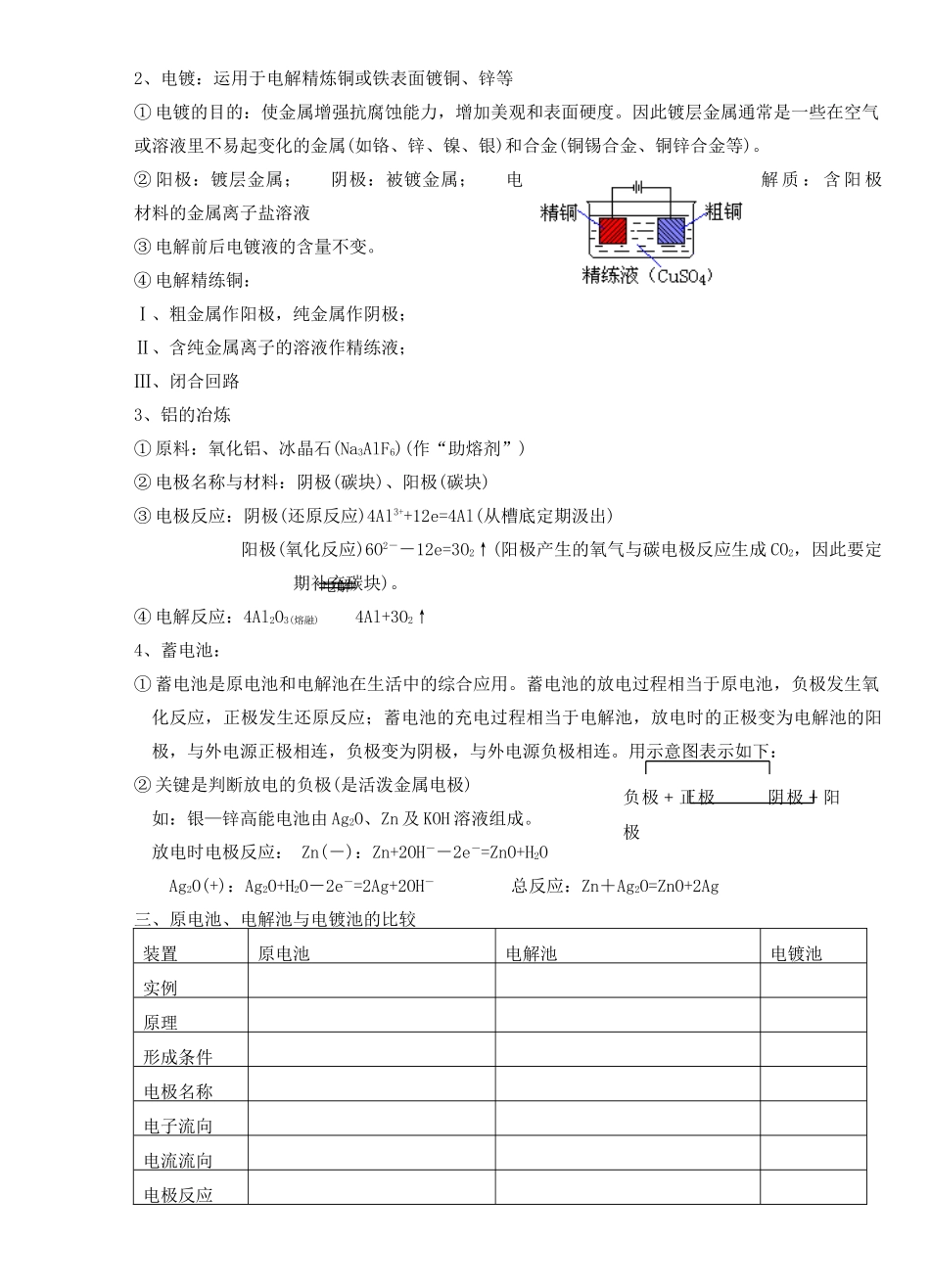
39 电解原理与应用一、本质和原理:1、本质:氧化还原反应,电流通过电解质溶液,在阴阳两极发生氧化还原反应的过程叫做电解。2、装置特点:是将电能转化为化学能的装置。①外电路必须有直流电源;②两极材料均能导电。3、电极名称:阳极——连接电源正极(所谓阳氧) 阴极——连接电源负极4、电子流向:电源负极 阴极 电源正极 阳极5、核心知识:放电顺序阳极放电顺序:活泼电极>S2-(S)>I-(I2)>Br-(Br2)>Cl-(Cl2)>OH-(O2)>含氧酸根离子>F-阴极放电顺序:Ag+>Hg2+>Fe3+(Fe2+)>Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+>H+(水)>Al3+>Mg2+>Ca2+>K+ 6、活泼电极指包括 Ag 之前的金属;惰性电极(Pt、Au、石墨)7、若阳极为活泼电极,阳极材料与电解质的阳离子一致,可能构成电镀池。总之:分析电解应用的主要方法思路通电前:电解质溶液的电离过程(包括电解质和水的电离)离子移向:阴离子移向阳极,阳离子移向阴极 放电 阳极:金属阳极>S2+>I->Br->Cl->OH->NO >SO42->F-。能力 阴极:Ag+>Hg2+>Fe3+>Cu2+>H+>P b2+>Sn2+>Fe2+>Zn2+>H+>Al3+通电后 >Mg2+>Na+>Ca2+>K+。电极反应:电极反应式、总反应式电解 两极现象、水的电离平衡 结果 离子浓度、溶液酸碱性、PH 值变化等二、工业运用1、氯碱工业① 原料的应用 A、粗盐的成分:泥沙、Ca2+、Mg2+、SO42-B、杂质的危害:生成沉淀损坏离子交换膜:得到的产品不纯。C、除杂试剂:a、BaCl2 b、NaOH c、Na2CO3 d、HCl D、试剂加入顺序:abc 过滤 d 或 acb 过滤 d 或 bac 过滤 d② 反应原理:2NaCl+2H2O ===2NaOH+H2↑+Cl2↑③ 电极名称与材料:阴极(碳棒)、阳极(铁棒)④ 电极反应:阴极(还原反应)2H++2e=H2↑ 阳极(氧化反应)2Cl-+2e=Cl2↑⑤ 离子方程式:2Cl-+2H2O 2OH-+ H2↑+ Cl2↑化学方程式:2NaCl+2H2O 2NaOH + H2↑+ Cl2↑ 阴极区 阳极区⑥ 立式隔膜电解槽(市售消毒器原理)ee电解电解2、电镀:运用于电解精炼铜或铁表面镀铜、锌等① 电镀的目的:使金属增强抗腐蚀能力,增加美观和表面硬度。因此镀层金属通常是一些在空气或溶液里不易起变化的金属(如铬、锌、镍、银)和合金(铜锡合金、铜锌合金等)。② 阳极:镀层金属; 阴极:被镀金属; 电解 质 : 含 阳 极材料的金属离子盐溶液③ 电解前后电镀液的含量不变。④ 电解精练铜:Ⅰ、粗金属作阳极,纯金属作阴极;Ⅱ、含纯金属离子的溶液...