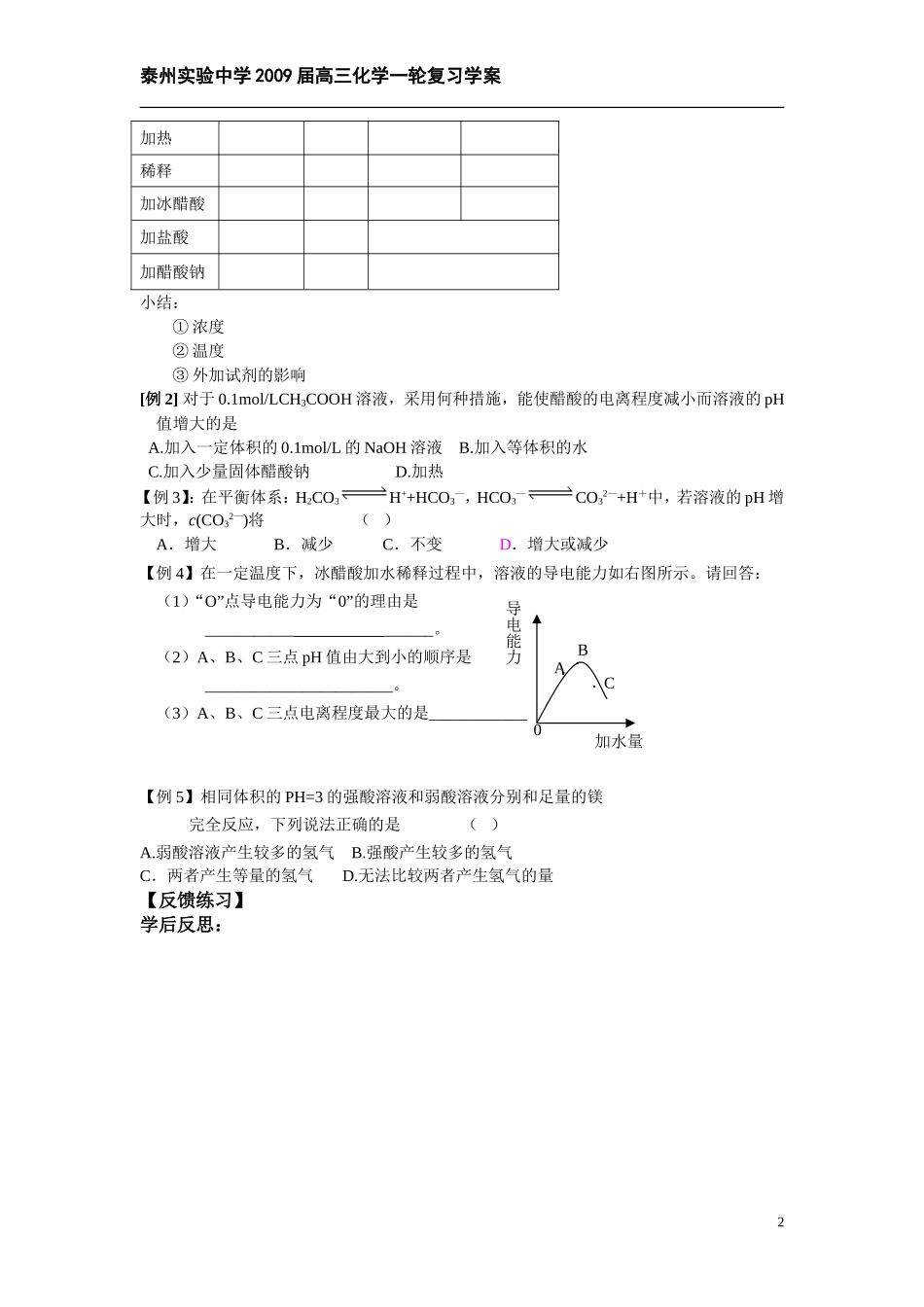
泰州实验中学 2009 届高三化学一轮复习学案专题十一 弱电解质的电离平衡【学习要求】1.了解电离、电解质、强电解质和弱电解质的概念。2.了解弱电解质在水溶液中的电离平衡。【学习重点】理解弱电解质的电离平衡.【学习难点】掌握一定条件下弱电解质电离平衡的移动【学法指导】 要理解弱电解质的相对强弱与电离程度的关系,进而从离子之间是否容易结合成分子的角度来理解弱电解质的相对强弱。因为“弱”所以不能全部电离,在水溶液中绝大部分以分子形式存在,在电离方程式中写成分子形式;因为“弱”所以存在电离平衡及平衡的移动。[知识梳理]一、电离平衡1.电解质(1)概念[讨论] 1.金属 Cu 常用作导线,NH3的水溶液能导电,能否说明 Cu 、NH3是电解质?2.总结金属导电与电解质导电的区别。(2)电解质溶液的导电其实质是 ,其导电能力的大小取决于 [讨论] 1.如何区别离子化合物和共价化合物? 2.在 0.1mol/LBa(OH)2溶液中逐滴滴入 0.1mol/LH2SO4溶液,溶液的导电能力将如何变化?试画出草图。 3.强电解质溶液的导电能力是否一定比弱电解质溶液强?2.强电解质与弱电解质(1)概念强电解质弱电解质电离程度化合物类型电离过程溶液中的微粒实例(2)电离与电离方程式[例 1]写出下列物质在水中发生电离的方程式NaCl、HCl、CH3COOH、NH3·H2OH2CO3、H3PO4、Al(OH)33.弱电解质的电离—电离平衡(1)电离平衡(2)影响电离平衡的因素对 CH3COOHH++CH3COO-的电离平衡条件变化平衡移动K离子数目离子浓度1泰州实验中学 2009 届高三化学一轮复习学案加热稀释加冰醋酸加盐酸加醋酸钠小结:① 浓度② 温度③ 外加试剂的影响[例 2] 对于 0.1mol/LCH3COOH 溶液,采用何种措施,能使醋酸的电离程度减小而溶液的 pH值增大的是 A.加入一定体积的 0.1mol/L 的 NaOH 溶液 B.加入等体积的水 C.加入少量固体醋酸钠 D.加热 【例 3】:在平衡体系:H2CO3H++HCO3—,HCO3—CO32—+H+中,若溶液的 pH 增大时,c(CO32—)将 ( )A.增大 B.减少 C.不变 D.增大或减少【例 4】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答:(1)“O”点导电能力为“0”的理由是___________ ______。(2)A、B、C 三点 pH 值由大到小的顺序是_______________________。(3)A、B、C 三点电离程度最大的是____________【例 5】相同体积的 PH=3 的强酸溶液和弱酸溶液分别和足量的镁完全反应,下...