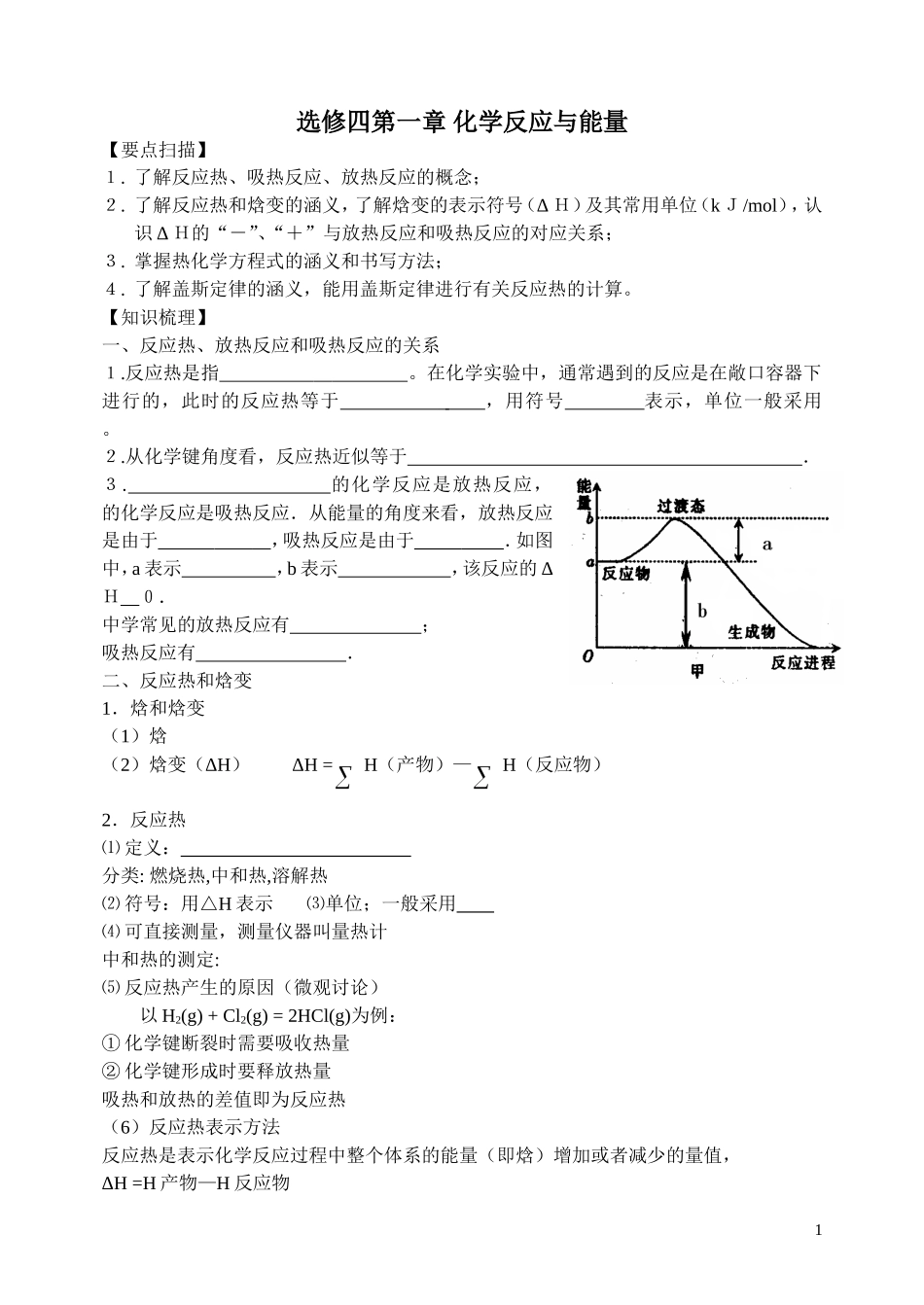
选修四第一章 化学反应与能量【要点扫描】1. 了解反应热、吸热反应、放热反应的概念;2. 了解反应热和焓变的涵义,了解焓变的表示符号(Δ H)及其常用单位(k J/mol),认识 Δ H的“-”、“+”与放热反应和吸热反应的对应关系;3. 掌握热化学方程式的涵义和书写方法;4. 了解盖斯定律的涵义,能用盖斯定律进行有关反应热的计算。【知识梳理】一、反应热、放热反应和吸热反应的关系1.反应热是指 。在化学实验中,通常遇到的反应是在敞口容器下进行的,此时的反应热等于 ,用符号 表示,单位一般采用 。2.从化学键角度看,反应热近似等于 .3. 的化学反应是放热反应, 的化学反应是吸热反应.从能量的角度来看,放热反应是由于 ,吸热反应是由于 .如图中,a 表示 ,b 表示 ,该反应的 ΔH 0.中学常见的放热反应有 ;吸热反应有 .二、反应热和焓变1.焓和焓变(1)焓(2)焓变(ΔH) ΔH =H(产物)—H(反应物)2.反应热⑴ 定义: 分类: 燃烧热,中和热,溶解热⑵ 符号:用△H 表示 ⑶单位;一般采用 ⑷ 可直接测量,测量仪器叫量热计中和热的测定:⑸ 反应热产生的原因(微观讨论) 以 H2(g) + Cl2(g) = 2HCl(g)为例:① 化学键断裂时需要吸收热量② 化学键形成时要释放热量吸热和放热的差值即为反应热(6)反应热表示方法反应热是表示化学反应过程中整个体系的能量(即焓)增加或者减少的量值,ΔH =H 产物—H 反应物1焓增加→吸热→则用“ ”表示;焓减少→放热→则用“ ”表示。(填“+”或“-”)3.反应热的计算(1)根据键能数据计算;ΔH=反应物的键能总和-生成物的键能总和。(2)根据热化学方程式计算;将 ΔH 看作热化学方程式中的一项,再按有关方程式的计算步骤、格式进行计算,得出有关数据。(3)盖斯定律三、热化学方程式1.热化学方程式的概念: 的化学方程式,叫做热化学方程式。热化学方程式不仅表示了化学反应中的 变化,也表明了化学反应中的 变化。2.书写热化学方程式时的注意点(1)要注明 ,但中学化学中所用 ΔH 的数据一般都是在 101kPa 和 25℃时的数据,因此可不特别注明;(2)需注明 ΔH 的“+”与“—”,“+”表示 ,“—”表示 ;比较 ΔH 的大小时,要考虑 ΔH 的正负。(3)要注明反应物和生成物的状态。g 表示 ,l 表示 ,s 表示 ;(4)各物质前的化学计量数表示 ,可以是整数也可以是分数。四、盖斯定律及其应用...