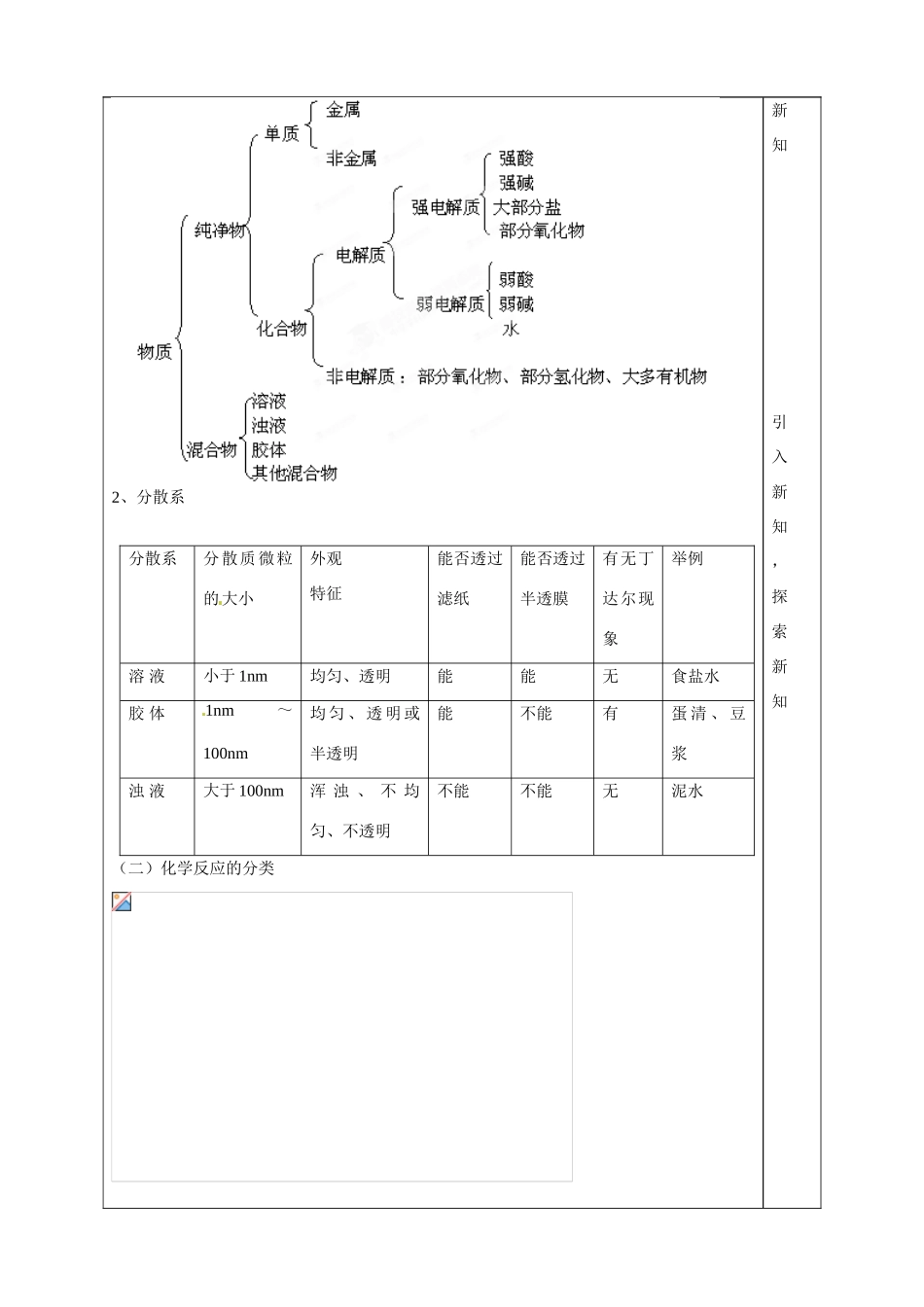
山东省泰安市肥城市第三中学 2013-2014 学年高中化学 第 2 章《元素与物质世界》复习学案 鲁科版必修 1学习内容学习指导即时感悟学习目标:1、物质简单分类法。2、胶体与其他分散系的区别3、电解质、非电解质的概念,掌握酸、碱、盐电离方程式的书写4、常见离子方程式的书写及离子反应发生的条件5、氧化还原反应、氧化剂、还原剂的概念,能判断电子转移的方向和数目6、铁及其化合物的氧化性和还原性学习重点:离子反应和氧化还原反应学习难点:离子反应和氧化还原反应 【回顾﹒预习】(一)物质的分类1、分类的意义和方法化学物质几千万种 ,我们不可能也没有必要去一一学习,对物质进行分类显得尤其重要。通过分类,不仅可以使知识系统化,还可以了解物质及其变化的规律,把握物质的本质属性和内在联系。 根据研究的需要,我们可以从多种不同的角度对物质进行分类,得到不同的分类结果。 例如:自我完成,回顾知识。 了解2、分散系分散系分散质微粒的大小外观特征能否透过滤纸能否透过半透膜有无丁达尔现象举例溶 液小于 1nm均匀、透明能能无食盐水胶 体1nm~100nm均 匀 、 透 明 或半透明能不能有蛋 清 、 豆浆浊 液大于 100nm浑 浊 、 不 均匀、不透明不能不能无泥水(二)化学反应的分类 新知 引入新知,探索新知 2、离子反应(1)定义:有离子参加的一类反应。(2)发生条件(复分解类型):生成难溶物、生成难电离物、生成挥发性物质。(3)表示方法——离子方程式3、氧化还原反应(1)特征:反应前后元素的化合价发生变化(2)实质:电子发生转移(3)概念和关系(4)电子转移的表示方法:双线桥 单线桥(三)铁及其化合物的氧化性和还原性1、铁元素的存在形态游离态: 化合态:2、氧化物、氢氧化物(1)氧化物: (2)氢氧化物氢氧化亚铁: 氢氧化铁:3、铁及其盐的氧化性和还原性(1)Fe 的还原性:与 Cl2 O2 H+、Cu2+、 Fe3+ 等反应,表现了铁较活泼的化学性质。 总结知识 分析题目、总结方法 (2)Fe3+的氧化性Fe3+具有较强的氧化性,可以将 Fe Cu Zn KI 等氧化,而本身被还原为 Fe2+. (3)Fe2+的氧化性和还原性思考:从化合价角度分析,为什么说 Fe2+既有氧化性又有还原性?① 氧化性:Fe2+可以被 Zn 还原。② 还原性:Fe2+可以被 Cl2 O2 KMnO4 HNO3 等氧化。小结:铁三角【自主﹒合作﹒探究】探究一、物质的分类 [例题分析]例 1、(1)在物质的分类中,下列属于同...