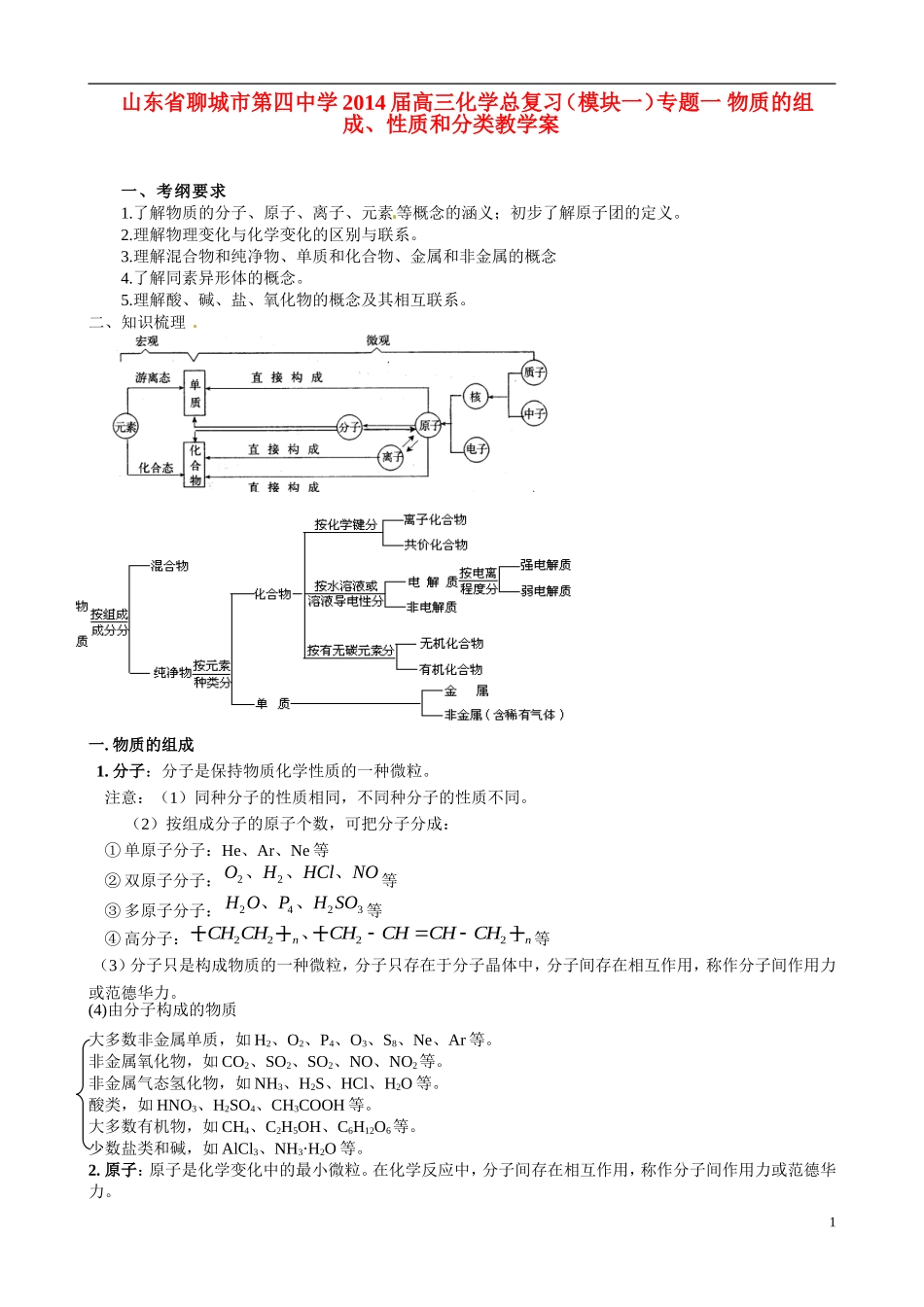
山东省聊城市第四中学 2014 届高三化学总复习(模块一)专题一 物质的组成、性质和分类教学案一、考纲要求1.了解物质的分子、原子、离子、元素等概念的涵义;初步了解原子团的定义。2.理解物理变化与化学变化的区别与联系。3.理解混合物和纯净物、单质和化合物、金属和非金属的概念4.了解同素异形体的概念。5.理解酸、碱、盐、氧化物的概念及其相互联系。二、知识梳理 一. 物质的组成 1. 分子:分子是保持物质化学性质的一种微粒。 注意:(1)同种分子的性质相同,不同种分子的性质不同。 (2)按组成分子的原子个数,可把分子分成: ① 单原子分子:He、Ar、Ne 等 ② 双原子分子:OHHClNO22、、、等 ③ 多原子分子: H OPH SO2423、、等 ④ 高分子: [][]CH CHCHCHCHCHnn2222、等(3)分子只是构成物质的一种微粒,分子只存在于分子晶体中,分子间存在相互作用,称作分子间作用力或范德华力。(4)由分子构成的物质大多数非金属单质,如 H2、O2、P4、O3、S8、Ne、Ar 等。非金属氧化物,如 CO2、SO2、SO2、NO、NO2等。非金属气态氢化物,如 NH3、H2S、HCl、H2O 等。酸类,如 HNO3、H2SO4、CH3COOH 等。大多数有机物,如 CH4、C2H5OH、C6H12O6等。少数盐类和碱,如 AlCl3、NH3·H2O 等。2. 原子:原子是化学变化中的最小微粒。在化学反应中,分子间存在相互作用,称作分子间作用力或范德华力。1 单质:金刚石、晶体硅等 原子构成的物质 原子晶体 化合物: SiOSiC2、等 3. 离子:离子是指带电荷的原子或原子团。(1)离子的种类 阳离子:、、、、、阴离子:、、、、、LiNaNHAlCHHFOHSOONH433242222(2)离子生成的途径(3)由离子构成的物质大多数盐类,如 NaCl、NH4Cl、KAl(SO4)2等。一些低价金属氧化物,如 Na2O、Na2O2、CaO 等。强碱,KOH、Ca(OH)2、Ba(OH)2等。其它化合物,如 CaC2、Mg3N2、NaH 等。 注意:在金属晶体中只有阳离子,而没有阴离子。4. 原子团:原子团指由多个原子结合成的集体,在化学反应中,它们作为一个集体参加化学反应。原子团包括复杂离子和基。如 MnOSONONHNO442342、、、、、 OH 等。 5. 元素:具有相同质子数的同类原子的总称。如 NNNNNN301234、、、、、、 N5称为氮元素。二. 物质的分类 1. 纯净物:由同种分子构成。具有固定的组成和一定的性质。如干冰、冰醋酸、重水、结晶水...