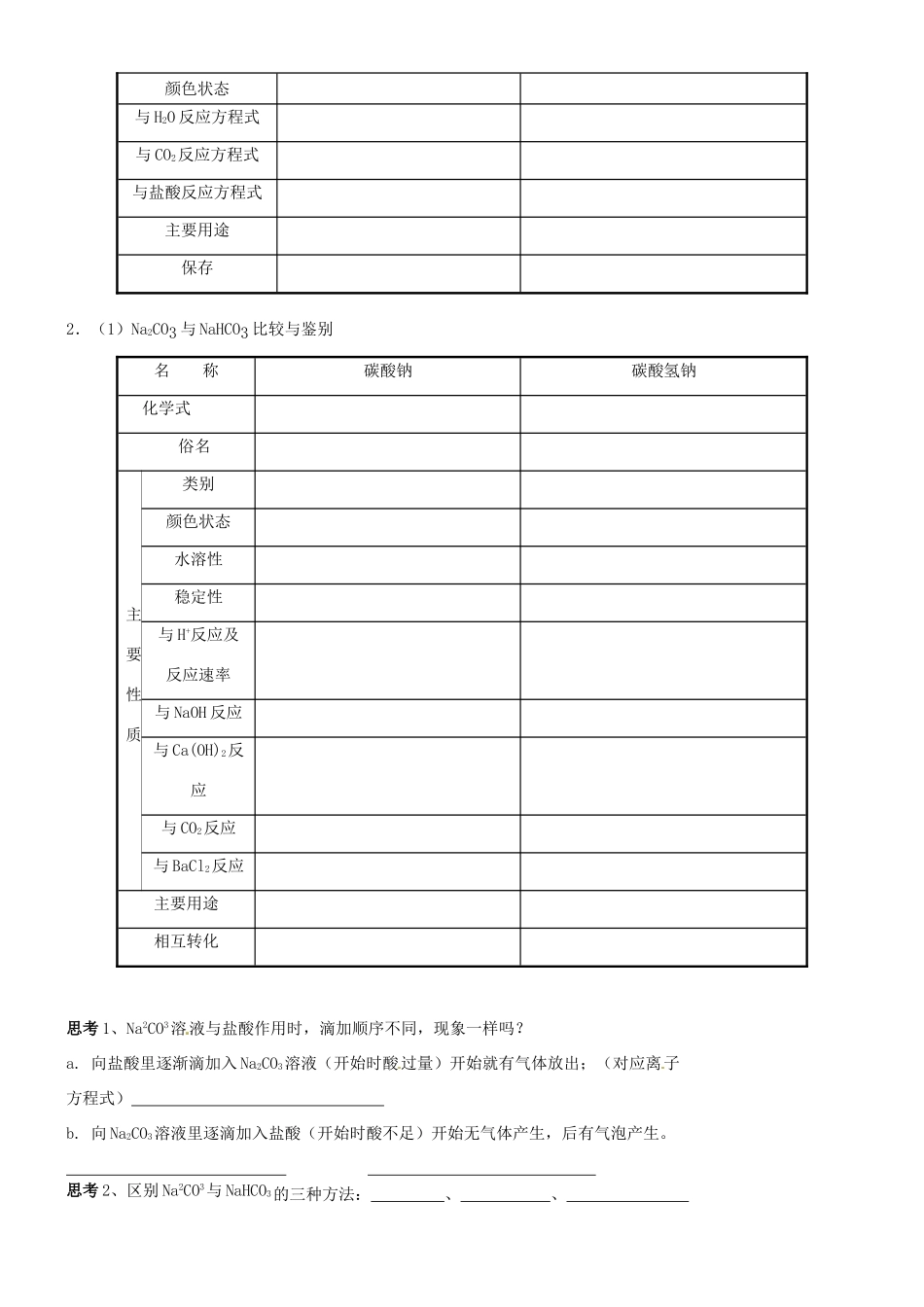
2014 年高中化学 金属钠及其化学物学案 新人教版必修 1一、钠的性质1.钠的物理性质钠是一种柔软、 色有 的 体,熔点较 ,密度比水 ,比煤油 。2.钠的化学性质:Na - e- → Na+ 化学反应中表现为 性 (1)与非金属单质的反应(写出下列方程式)a.与氯气反应: b.与硫反应 : c.与氧气反应①常温下,现象: 化学方程式: ② 加热时,现象: 化学方程式: (2)与水反应化学方程式: 现象: 思考:钠与水反应的现象说明钠具有哪些性质? (3)与稀酸溶液的反应(写离子方程式) (4)与某些盐的反应a.与熔融盐 Na+TiCl4 。b.与盐溶液:NaCl 溶液 。CuSO4溶液 FeCl3溶液 Na 投入到 NH4Cl 溶液中,有 H2和 NH3逸出。 思考:钠在空气中放置一段时间,将发生哪些变化?最终产物是什么?如何保存?银白色金属钠 二、钠的化合物1.氧化钠和过氧化钠的比较氧化钠过氧化钠化学式氧元素的化合价阴阳离子个数比稳定性颜色状态与 H2O 反应方程式与 CO2反应方程式与盐酸反应方程式主要用途保存2.(1)Na2CO3 与 NaHCO3 比较与鉴别名 称碳酸钠碳酸氢钠化学式俗名主要性质类别颜色状态水溶性稳定性与 H+反应及反应速率与 NaOH 反应与 Ca(OH)2反应与 CO2反应与 BaCl2反应主要用途相互转化思考 1、Na2CO3溶液与盐酸作用时,滴加顺序不同,现象一样吗?a. 向盐酸里逐渐滴加入 Na2CO3溶液(开始时酸过量)开始就有气体放出;(对应离子方程式) b. 向 Na2CO3溶液里逐滴加入盐酸(开始时酸不足)开始无气体产生,后有气泡产生。 思考 2、区别 Na2CO3与 NaHCO3的三种方法: 、 、 三、碱金属元素(一)碱金属元素的原子结构共同点:原子的最外层均为 个电子,都易 1 个电子而表现 性;不同点:核电荷数逐渐增多;电子层数逐渐增大;原子半径依次增大,失电子能力逐渐增强;单质还原性逐渐增强。即还原性:Li < Na < K < Rb < Cs (二)单质性质的递变规律碱金属LiNaKRbCs颜色状态银白色晶体银白色晶体银白色晶体银白色晶体银白色晶体略带金色密 度由小到大(K 与 Na 相反)熔 点依次降低金属性依次增强跟 O2反应产物Li2ONa2O、Na2O2K2O、K2O2、KO2Rb2O、Rb2O2、RbO2 Cs2O、Cs2O2、CSO2跟水反应现 象不融化,较剧烈融化,剧烈爆炸爆炸爆炸产 物LiOH 和 H2↑NaOH 和 H2↑KOH 和 H2↑RbOH 和 H2↑CsOH 和 H2↑跟酸反应置换出氢气,生成碱金属盐保存方法石蜡中煤油中...