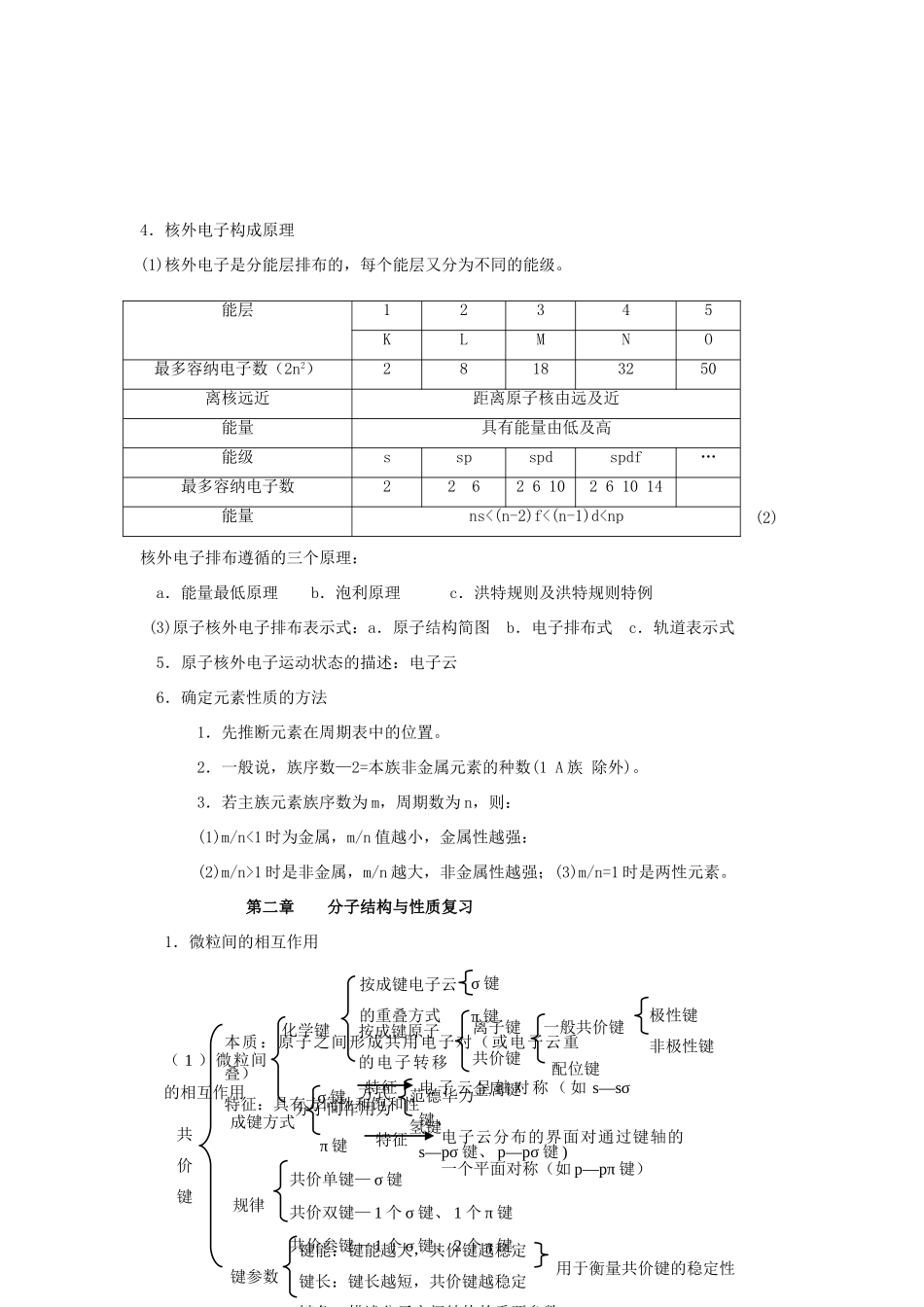
知识归纳 新人教版选修 3第一章 原子结构与性质知识点归纳1.原子结构 2.位、构、性关系的图解、表解与例析(1)元素在周期表中的位置、元素的性质、元素原子结构之间存在如下关系:(2)元素及化合物性质递变规律表解同周期:从左到右同主族:从上到下核电荷数逐渐增多逐渐增多电子层结构电子层数相同,最外层电子数递增电子层数递增,最外层电子数相同原子核对外层电子的吸引力逐渐增强逐渐减弱主要化合价正价+1 到+7 负价-4 到-1最高正价等于族序数(F、O 除外)元素性质金属性逐渐减弱,非金属性逐渐增强电离能增大,电负性增大金属性逐渐增强,非金属性逐渐减弱,第一电离能逐渐减小,电负性逐渐减小最高价氧化物对应水化物的酸性增强碱性减弱酸性减弱碱性增强决定整个原子不显电性各层电子数最外层电子数决定主族元素的化学性质原子的电子式原子ZAX原子核质子中子核电荷数决定元素种类决定原子种类质量数近似相对原子质量同 位 素 ( 两 个 特性)核外电子电子数电子排布电子层原子结构示意图元素性质同周期:从左到右递变性同主族:从上到下 相似性 递变性主族:最外层电子数 = 最高正价 =8- 负价原子半径 原子得失最外层电子数 电子的能力位置原子序数 = 质子数主族序数 = 最外层电子数周期数 = 电子层数原子结构酸碱性非金属气态氢化物的形成和热稳定性气态氢化物形成由难到易,稳定性逐渐增强气态氢化物形成由易到难,稳定性逐渐减弱3.元素的结构和性质的递变规律随着原子序数递增原子结构呈周期性变化原子半径呈周期性变化元素主要化合价呈周期性变化元素的金属性与非金属形呈周期性变化元素原子的第一电离能呈周期性变化元素的电负性呈周期性变化元素周期律排列原则按原子序数递增的顺序从左到右排列将电子层数相同的元素排成一个横行把最外层电子数相同的元素(个别除外),排成一个纵行周期(7个横行)短周期(第一、二、三周期)长周期(第四、五、六周期)不完全周期(第七周期) 性质递变原子半径主要化合价元素性质金属性强弱判断实验标志非金属性强弱判断实验标志元素周期表族( 18个纵行)主族(第Ⅰ A 族—第Ⅶ A 族共七个)副族(第Ⅰ B 族—第Ⅶ B 族共七个)第Ⅷ族(第 8—10 纵行)零族(稀有气体)结构4.核外电子构成原理(1)核外电子是分能层排布的,每个能层又分为不同的能级。(2)核外电子排布遵循的三个原理: a.能量最低原理 b.泡利原理 c.洪特规则及洪特规则特例 (3)...