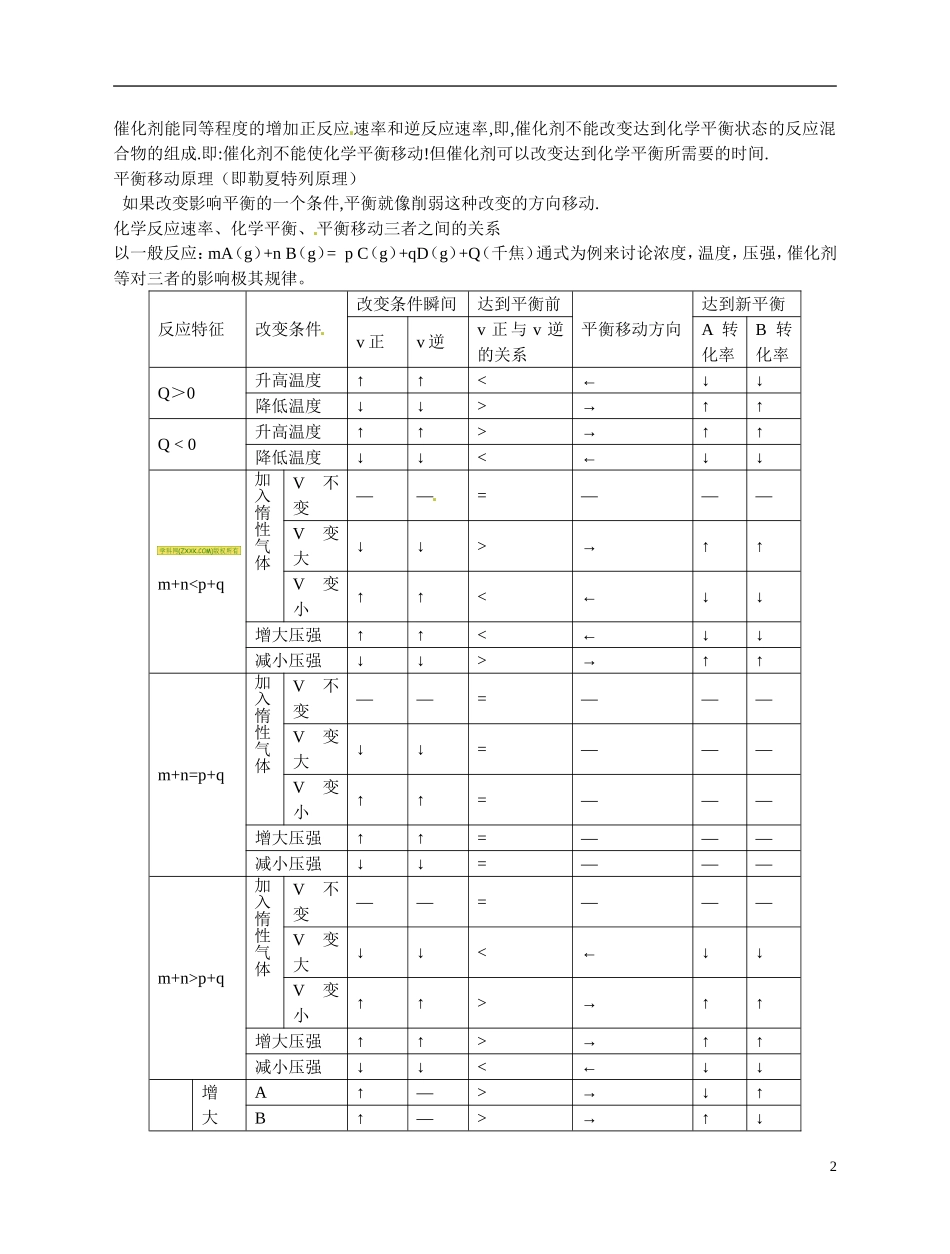
福建省漳州市芗城中学高二化学 化学平衡的移动教案一、教学目的要求:1、使学生理解浓度,压强和温度等条件对化学平衡的影响.2、使学生理解化学平衡的移动.二、本节重难点:重点: 浓度,压强和温度等条件对化学平衡的影响.难点: 平衡移动原理的应用.课时安排:1 课时教学过程:导言: 我们研究化学平衡的目的,不是要保持一个化学平衡不变.而是要研究如何利用外界条件的改变,去破坏化学平衡.使之向我们所希望的方向转变,去建立新的化学平衡.化学平衡的移动:可逆反应中,旧化学平衡的破坏,新化学平衡的建立的过程就叫做化学平衡的移动.浓度对化学平衡的影响:做实验:实验 1、2实验证明: 加入硝酸溶液变橙色,加入 NaOH 溶液变黄色。说明加入硝酸溶液化学平衡向正反应的方向移动了,加入 NaOH 溶液化学平衡向正反应的方向移动。无数实验证明:增大任何一种反应物的浓度,都可以使化学平衡向正反应方向移动。增大任何一种生成物的浓度,都可以使化学平衡向逆反应方向移动。减小任何一种反应物的浓度,都可以使化学平衡向逆反应方向移动。减小任何一种生成物的浓度,都可以使化学平衡向正反应方向移动。(二)压强对化学平衡的影响:处于平衡状态的反应混合物里,无论是反应物,还是生成物,只要有气态物质存在,压强的改变,就有可能使化学平衡移动。如:3222NH3HN高温高压催化剂反应中,1 体积氮气和 3 体积的氢气反应,生成了 2 体积的氨气。反应后,气体总体积减少了!可知,对这种气体总体积减少的反应,增大压强,平衡向正反应方向移动。即:增大压强,平衡向体积缩小的方向移动;减小压强,平衡向体积增大的方向移动。气体总体积不变化,改变压强,化学平衡不移动!如:222HCOO(g)HCO反应前后,气体物质总体积不变。改变压强,平衡不移动!(三)温度对化学平衡的影响:在吸热或放热的可逆反应中,反应混合物达平衡后,改变温度,也会使化学平衡移动.在可逆反应中,正反应如果放热,则,逆反应必定吸热!反之亦然.做实验:P51 页实验由实验可知: 升高温度,(混合气体颜色加深,)平衡向吸热反应的方向移动. 降低温度,(混合气体颜色变浅,)平衡向放热反应的方向移动催化剂对化学平衡的影响:1催化剂能同等程度的增加正反应 速率和逆反应速率,即,催化剂不能改变达到化学平衡状态的反应混合物的组成.即:催化剂不能使化学平衡移动!但催化剂可以改变达到化学平衡所需要的时间.平衡移动原理(即勒夏特列原理) 如果改变影响平衡的一个条件,...