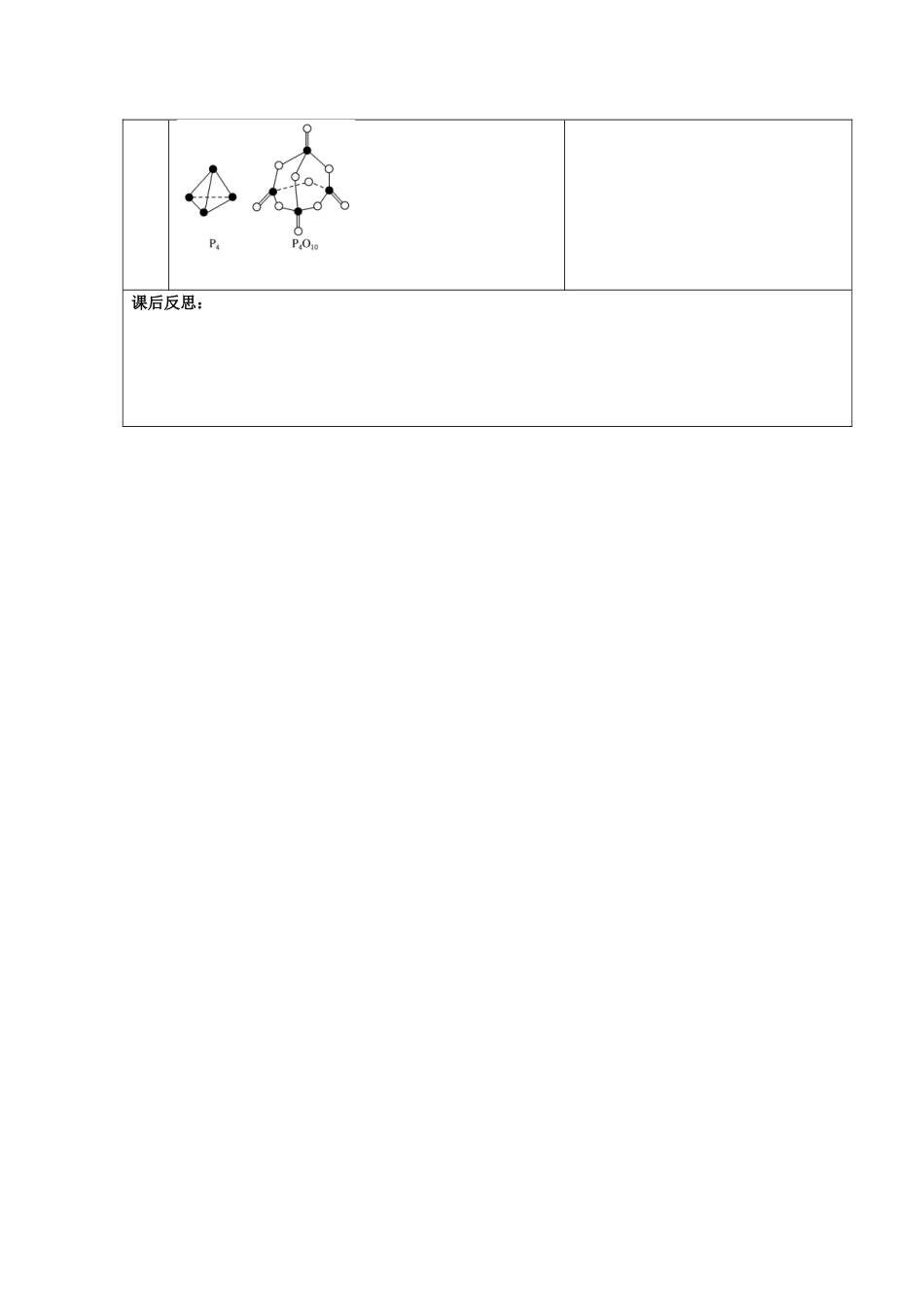
甘肃省金昌市第一中学 2014 年高中化学 1-1-2 化学反应与能量的变化导学案 新人教版选修 4 学习目标1.了解焓变的含义 2.理解反应热与焓变的关系,与键的断裂与生成的关学习重点反应热与焓变的关系 学习难点反应热与焓变的关系 精讲与点拨自主研讨【自主学习】二、焓变 反应热1.焓变与反应热的关系焓是与_____有关的物理量,焓变是________________的焓值差,符号 ΔH,单位常用______________条件下的反应热效应等于焓变。2.ΔH 的正、负与吸热反应、放热反应的关系(1)放热反应:反应完成时,生成物释放的总能量_____反应物吸收的总能量的反应。由于反应后放出热量(释放给环境)能使反应体系的能量_______,因此ΔH____0( 填 “ >” 或 “ <”) , 即 ΔH 为 ___ ( 填“+”或“-”)。(2)吸热反应:反应完成时,生成物释放的总能量_____反应物吸收的总能量的反应。由于反应通过 ____________等吸收能量(能量来自环境),而使反应体系的能量______,因此 ΔH___0(填“>”或“<”),即ΔH 为___ (填“+”或“-”)。合 作互【例题精讲】例 1 : 1molC 与 1molH2O(g) 反 应 生 成 1molCO(g) 和1molH2(g),需吸收 131.5kJ 的热量,该反应的反应热为△H= kJ/mol。例 2:拆开 1molH—H 键、1molN—H 键、1molN≡N 键分别需要的能量是 436kJ、391kJ、946kJ,则 1molN2动生成 NH3的反应热为 ,1mol H2生成 NH3的反应热为 。 检测与评价【基础强化】1.判断下列说法是否正确(1)物质发生化学变化都伴随着能量变化( )(2)有能量变化的都是化学变化( )(3)热化学方程式中,化学计量数既可表示物质的量,又可表示分子个数( )(4)煤燃烧时化学能只转化为热能( )(5)若旧化学键断裂吸收的能量大于新化学键形成释放的能量,则该反应为放热反应( )2.已知 1mol 甲烷燃烧放出 890.3KJ 的热量,在标准状况下,1m3甲烷完全燃烧可放出的热量为 ( )A.890.3KJ B.39745.5KJ C.1979KJ D.19855KJ【能力提升】1.对于放热反应 2H2+O2=====2H2O,下列说法中正确的是( )A.产物 H2O 所具有的总能量高于反应物 H2 和 O2 所具有的总能量B.反应物 H2和 O2所具有的总 能量高于产物 H2O 所具有的能量C.反应物 H2 和 O2 所具有的总能量等于产物 H2O 所具有的能量2.白磷与氧气可发生如下反应:P4+5O2===P4O1 0。已知断裂下列化学键需要吸收的能量分别为:P—P akJ·mol-1、P—O b kJ·mol-1、P=O c kJ·mol-1、O=O d kJ·mol-1。根据图示的分子结构和 有关数据估算该反应的 ΔH,其中正确的是( )课后反思: