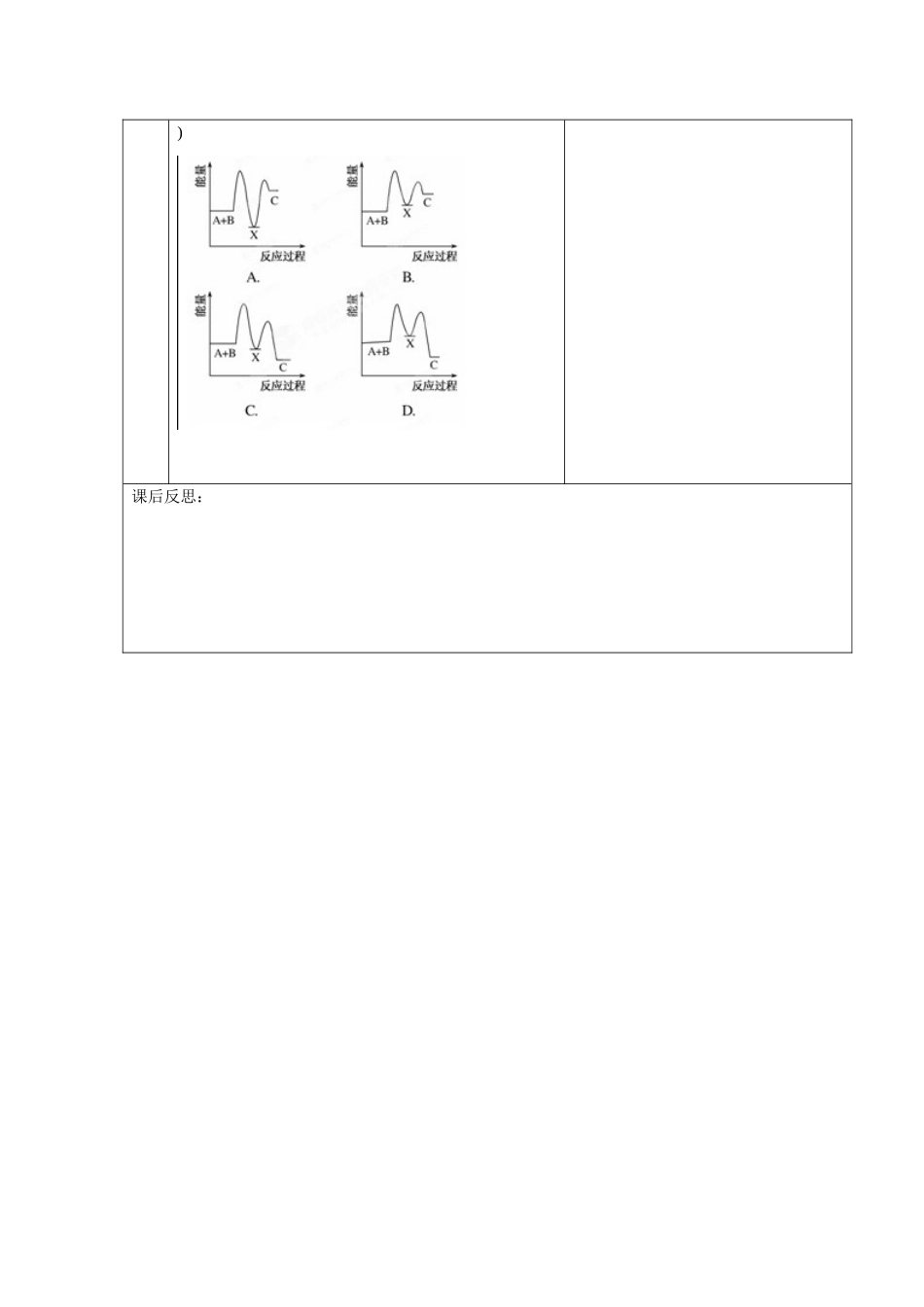
甘肃省金昌市第一中学 2014 年高中化学 第一章 专题二 ΔH 大小的比较导学案 新人教版选修 4 学习目标1. 学会 ΔH 大小的比较2.会根据图像比较 ΔH 的相对大小学习重点ΔH 大小的比较学习难点ΔH 大小的比较 精讲与点拨自主研讨【自主学习】二、ΔH 大小的比较1.直接比较法依据规律、经验和常识可以直接判断不同反应的 ΔH的大小。如(1)吸热反应的 ΔH 肯定比放 热反应的 (前者 0,后者 0);(2)2 mol H2 燃烧放出的热量肯定比 1 mol H2 燃烧放出的热量 ;(3)等量的碳燃烧完全生成 CO2 所放出的热量肯定比不完全燃烧生成 CO 所放出的热量 ;(4)生成等量的水时强酸和强碱的稀溶液反应比弱酸和强碱或弱碱和强酸的稀溶液反应放出的热量 。2.盖斯定律法依据盖斯定律,化学反应的反应热只与反应的 (反应物)和 (生成物)有关 ,而与反应进行的 无关。热化学方程式可以像一个代数式一样进行 、 (乘以某个数后)相加减等多种数学运算。依据进行数学运算后所得的新反应或过程的 ΔH 可以比较运算前的各 ΔH 的大小。合 作互动【例题精讲】例 1:已知胆矾溶于水时溶液温度降低。胆矾分解的热化学方程式为 CuSO4·5H2O(s)===CuSO4(s)+5H2O(l) ΔH=+Q1 kJ/mol。室温下,若将 1 mol 无水硫酸铜溶解为溶液时放热 Q2 kJ,则( )A.Q1>Q2 B.Q1=Q2C.Q10),② X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )课后反思: