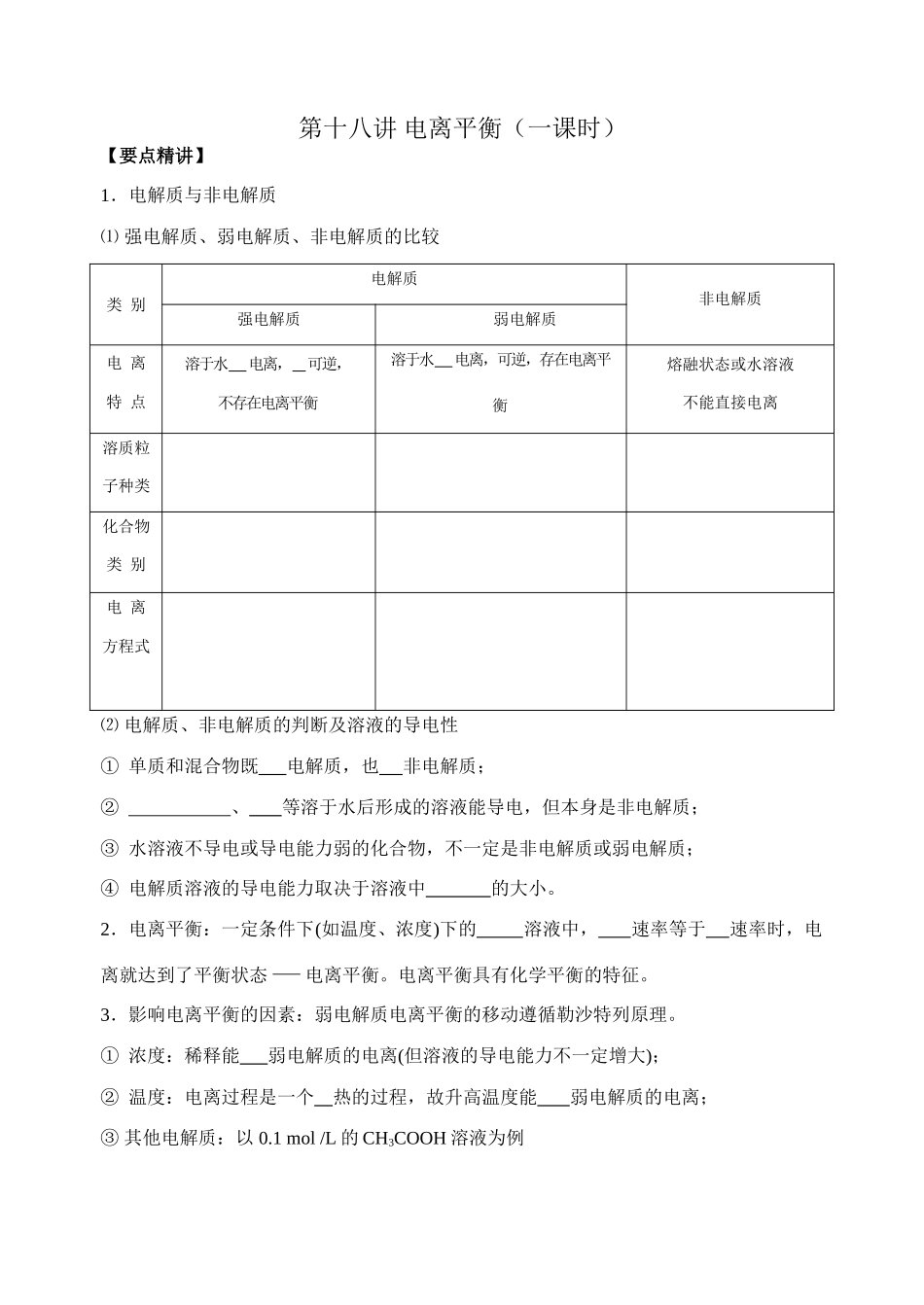
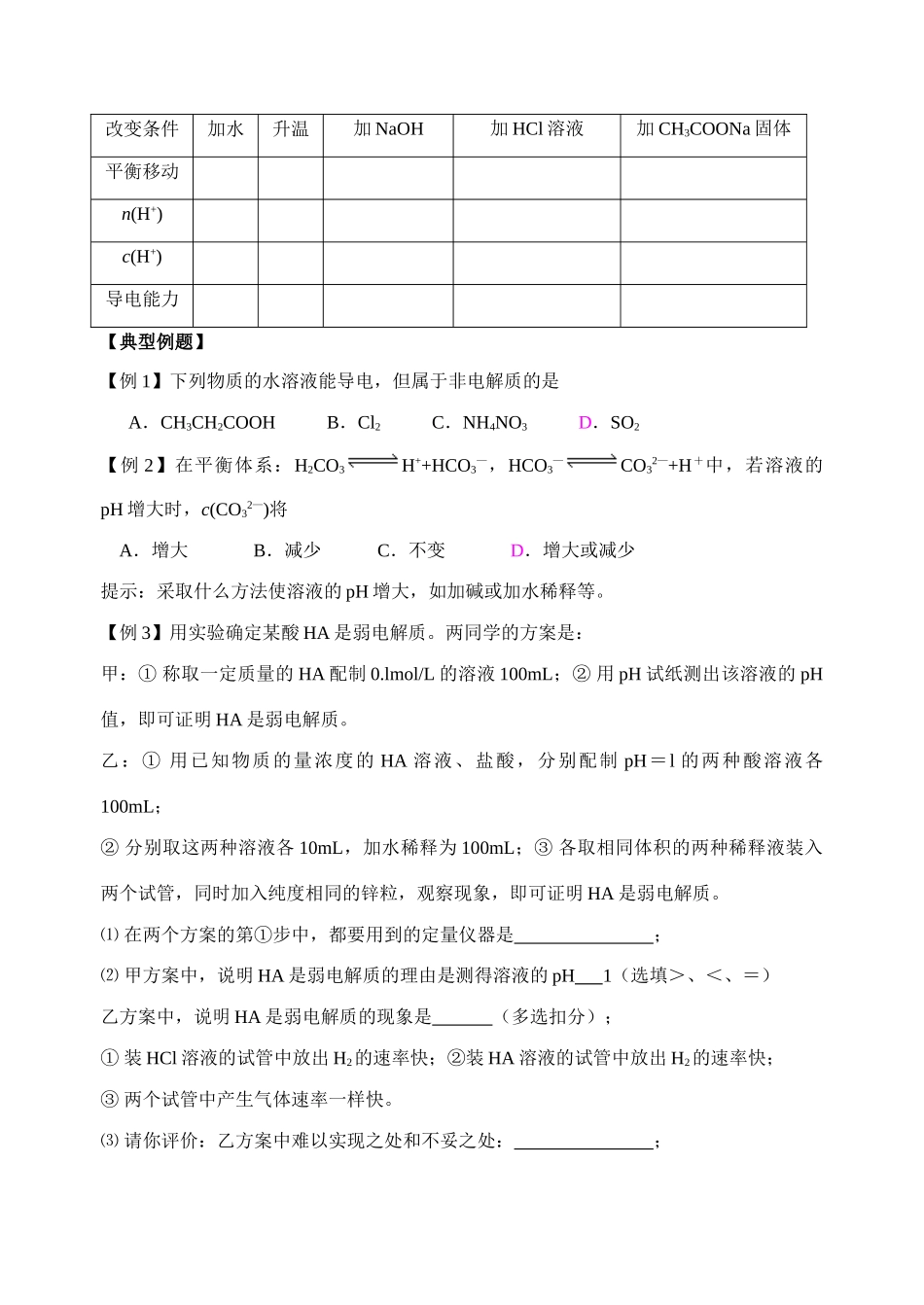
第十八讲 电离平衡(一课时)【要点精讲】1.电解质与非电解质⑴ 强电解质、弱电解质、非电解质的比较类 别电解质非电解质强电解质弱电解质电 离特 点溶于水 电离, 可逆,不存在电离平衡溶于水 电离,可逆,存在电离平衡熔融状态或水溶液不能直接电离溶质粒子种类化合物类 别电 离方程式⑵ 电解质、非电解质的判断及溶液的导电性① 单质和混合物既 电解质,也 非电解质;② 、 等溶于水后形成的溶液能导电,但本身是非电解质;③ 水溶液不导电或导电能力弱的化合物,不一定是非电解质或弱电解质;④ 电解质溶液的导电能力取决于溶液中 的大小。2.电离平衡:一定条件下(如温度、浓度)下的 溶液中, 速率等于 速率时,电离就达到了平衡状态-电离平衡。电离平衡具有化学平衡的特征。3.影响电离平衡的因素:弱电解质电离平衡的移动遵循勒沙特列原理。① 浓度:稀释能 弱电解质的电离(但溶液的导电能力不一定增大);② 温度:电离过程是一个 热的过程,故升高温度能 弱电解质的电离;③ 其他电解质:以 0.1 mol /L 的 CH3COOH 溶液为例改变条件加水升温加 NaOH加 HCl 溶液加 CH3COONa 固体平衡移动n(H+)c(H+)导电能力【典型例题】【例 1】下列物质的水溶液能导电,但属于非电解质的是A.CH3CH2COOH B.Cl2 C.NH4NO3 D.SO2【例 2】在平衡体系:H2CO3H++HCO3—,HCO3—CO32—+H+中,若溶液的pH 增大时,c(CO32—)将A.增大 B.减少 C.不变 D.增大或减少提示:采取什么方法使溶液的 pH 增大,如加碱或加水稀释等。【例 3】用实验确定某酸 HA 是弱电解质。两同学的方案是:甲:① 称取一定质量的 HA 配制 0.lmol/L 的溶液 100mL;② 用 pH 试纸测出该溶液的 pH值,即可证明 HA 是弱电解质。乙:① 用已知物质的量浓度的 HA 溶液、盐酸,分别配制 pH=l 的两种酸溶液各100mL;② 分别取这两种溶液各 10mL,加水稀释为 100mL;③ 各取相同体积的两种稀释液装入两个试管,同时加入纯度相同的锌粒,观察现象,即可证明 HA 是弱电解质。⑴ 在两个方案的第①步中,都要用到的定量仪器是 ;⑵ 甲方案中,说明 HA 是弱电解质的理由是测得溶液的 pH 1(选填>、<、=)乙方案中,说明 HA 是弱电解质的现象是 (多选扣分);① 装 HCl 溶液的试管中放出 H2的速率快;②装 HA 溶液的试管中放出 H2的速率快;③ 两个试管中产生气体速率一样快。⑶ 请你评价:...