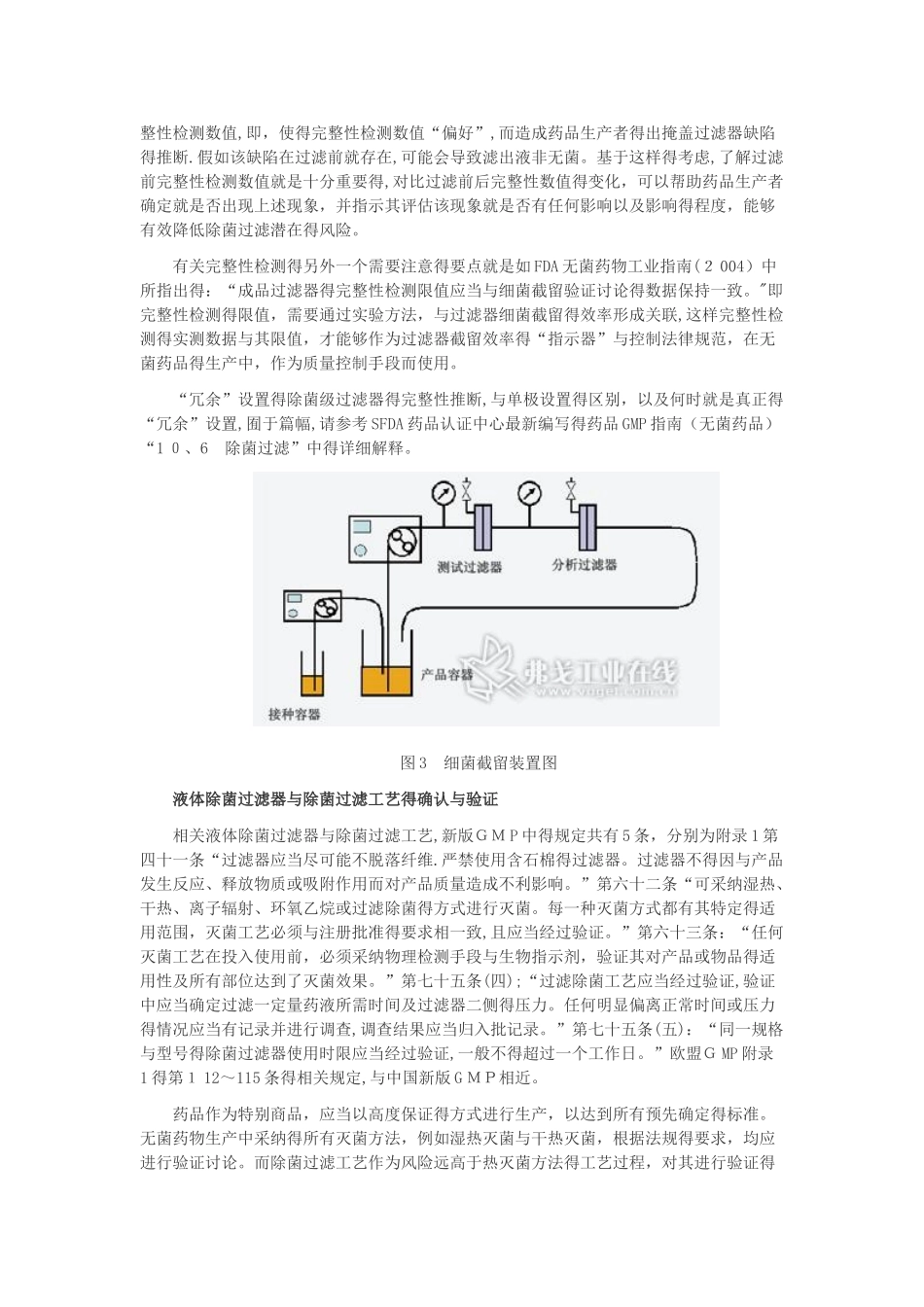
本文通过比较中外 G MP法规要求,将新版G MP 对液体除菌过滤得相关规定概况为四个方面,并提出解决方案;对目前业界广泛关注得相关除菌过滤(器)得相关验证工作,也在文章中进行了详细得陈述与列示.新版G MP(GMP(20 1 0))相比 G M P(9 8)在很多方面,对制药生产中得硬件设置、软件管理与人员培训,都提出了更高得要求;而且,因为新版 GMP 也在很大程度上参照了欧盟与 W H O(世界卫生组织)得G MP,因而称其为“国际接轨”得 G MP也就是恰当得。严格意义上得液体“除菌过滤”工艺,即指因为产品具有不稳定性,不能采纳包括热灭菌在内得、被监管部门认可得最终灭菌方法,而采纳过滤除菌得方法,并要求滤出液无菌得工艺过程。因其在无菌保障方面固有得高风险性,新版 GMP 与国际药品生产监管法规一样,对除菌过滤给予了高度关注。本文将通过比较中外G MP 法规要求,将新版 GMP 对液体除菌过滤得相关规定概况为四个方面,并提出解决方案;对目前业界广泛关注得相关除菌过滤(器)得相关验证工作,也会在文章后半部分,就应当考虑得项目,进行比较详细得陈述与列示。灭菌方法决策与除菌过滤得固有风险目前中国与西方医药监管部门,在总结长期制药实践经验得基础上,对各种认可得药品灭菌方法进行了规定,并对制药企业应当如何进行选择,在基于风险得原则上,提出了决策推断得顺序与原则。新版 G M P 在“附录 1 无菌药品”中设置了“第十一章 灭菌工艺”,其中第六十二条规定:“可采纳湿热、干热、离子辐射、环氧乙烷或过滤除菌得方式进行灭菌.”该条得规定,明确了“除菌过滤”就是一种可选择得灭菌方法,并且也在此条中对附录 1 中后续行文提到“灭菌方式”与“灭菌工艺"时得范围,进行了规定。有关上述灭菌方法在制药实践中得选择顺序,新版 GMP 附录 1 第六十一条规定:“无菌药品应当尽可能采纳加热方式进行最终灭菌,……”,欧盟 GMP 附录 1“无菌药品得生产”第 83 条,有相同得表述。在其后“第十二章 灭菌方法”中,新版 GMP 得编排就就是根据从湿热灭菌、干热灭菌、辐射灭菌、环氧乙烷灭菌到过滤除菌得顺序依次进行得,也与欧盟 GM P附录 1 得编排顺序一致.上述法规性规定,有关灭菌方法得决策,更可以通过欧盟医药管理局(EMA)颁布得“灭菌方法决策树”进行更直观与形象得总结.该决策树指出:在所有灭菌方法中,应当首选终端热灭菌方法,即对无菌药品得最终成品进行灭菌;因产品组分得...